Fizikai tulajdonságaik: a nyílt láncú, elágazás
nélküli, telített szénhidrogének apolárisak. A butánig gáz, az oktadekánig
folyadék, a magasabb szénatomszámúak szilárd halmazállapotúak.
Kémiai tulajdonságaik: elektronszerkezetük nagyon
kiegyensúlyozott, sem elektronhiányuk, sem elektromfeleslegük nincs a molekulán
belül. Ennek megfelelően nem túl reakcióképes vegyületek.
A metán ultraibolya fény hatására reagál halogénekkel. Egyik hidrogénjét
halogénre cseréli.
CH4 + Cl2 = CH3Cl + HCl
A kémiai átalakulás neve: szubsztitúció.
Az olyan kémiai átalakulásokat, amelyek eredményeként a kiindulási molekula
egyik atomja vagy atomcsoportja más atomra vagy atomcsoportra cserélődik ki
szubsztitúciónak nevezzük.
Meggyújtva a levegő oxigénjével tökéletes égés mellett reagálnak.
A reakció neve: oxidáció.
CH4 + 2O2 = CO2 + 2H2O
A paraffinok vízben gyakorlatilag nem oldódnak.
Előfordulásuk: földgáz, kőolaj
Felhasználásuk: energiaforrások
 Érdemes
meglátogatnod az alábbi oktatási oldalakat!
Érdemes
meglátogatnod az alábbi oktatási oldalakat!
Metán,
telített
szénhidrogének.
Kiegészítés:* a szénláncok elágazásokat,
oldalláncokat is tartalmazhatnak. Tulajdonságaik megismerése előtt szükséges
a csoport fogalmának megismerése, amely így hangzik: a mulekula
általunk tetszőlegesen körülhatárolt egy-egy részlete. Ha a csoport csak egy
hidrogénatommal tartalmaz kevesebbet, mint egy alkánmolekula, akkor úgy nevezzük
el, hogy az azonos szénatomszámú alkán nevének -án végződését -il
végződéssel helyettesítjük. Pl: metil-csoport -CH3.
Két vagy három szénatom csak egyféleképpen kapcsolódhat lánccá,
négy szénatom kapcsolódására azonban már két lehetőség van. Az azonos összegképletű,
de különböző szerkezetű molekulákat egymás konstitúciós izomerjeinek
nevezzük. (A molekulát felépítő atomok kapcsolódási sorrendjét a molekula
konstitúciójának nevezzük.) Nézzük meg a jelenséget a bután
példáján! Ha nem ágazik el a szénlánc a vegyület neve: bután, ha
közepén van egy elágazás izomerje a butánnak, elnevezése: izobután.
 |
Balra bután, jobbra izobután. |
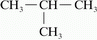 |
 Abban
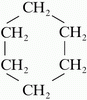
az esetben, ha a szénlánc gyűrűvé záródik a szénhidrogénlánc neve elé illesztjük
a ciklo szócskát. Pl.: ciklopropán, ciklobután...
A képen a ciklohexán látható. Sok olyan természetes és mesterséges vegyületet
ismerünk, amelynek molekuláiban a szénatomok többgyűrűs vázat alkotnak. Ezek
közül most a szteroidokat említjük meg, melyek közös "alapvegyülete"
a szteránváz (más néven gonán).
Abban
az esetben, ha a szénlánc gyűrűvé záródik a szénhidrogénlánc neve elé illesztjük
a ciklo szócskát. Pl.: ciklopropán, ciklobután...
A képen a ciklohexán látható. Sok olyan természetes és mesterséges vegyületet
ismerünk, amelynek molekuláiban a szénatomok többgyűrűs vázat alkotnak. Ezek
közül most a szteroidokat említjük meg, melyek közös "alapvegyülete"
a szteránváz (más néven gonán).
1.2. Telítetlen szénhidrogének
Telítetlen szénhidrogéneknek két csoportját ismerjük meg, az alkéneket és
az alkineket.
1.2.1. Telítetlen szénhidrogének - alkének
Az alkének (olefinek) olyan szénhidrogének melyek legalább
egy kettős kötést tartalmaznak.
Elnevezés: az alkének neve -én szótagra
végződik.
Fizikai tulajdonságaik: az alkánokhoz hasonló tulajdonságúak,
hisz az alkének is apolárisak.
 Kémiai
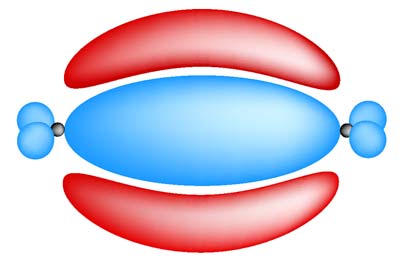
tulajdonságaik: a két kovalens kötés közül az egyik pontosan
a szénatomok között található (szigma-kötés), a másik a szigma-váz
síkja alatt és fölött helyezkedik el (pi-kötés). Utóbbi erőssége a szigmáénál
valamivel gyengébb, így könnyen reakcióba hozható. Ennek megfeleleően az alkének
reakcióképesebbek, mint az alkánok.
Kémiai
tulajdonságaik: a két kovalens kötés közül az egyik pontosan
a szénatomok között található (szigma-kötés), a másik a szigma-váz
síkja alatt és fölött helyezkedik el (pi-kötés). Utóbbi erőssége a szigmáénál
valamivel gyengébb, így könnyen reakcióba hozható. Ennek megfeleleően az alkének
reakcióképesebbek, mint az alkánok.
A pi kötésnek köszönhetően a szénatomok közötti kötéstengelymenti csavarodása
nem lehetséges, a csoportok viszonylagos helyzete rögzített. A jelenséget
geometriai izomérianak nevezzük.
Égésük tökéletlen, tehát kormozó lánggal égnek. 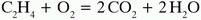
A kettős kötés miatt ún. addíciós reakcióra hajlamosak. Az addíció
olyan reakció, amelyben két molekula melléktermék nélkül egyesül.
Ábrán hidrogén- és halogénaddíció.


Megfelelő katalizátor hatására polimerizáós reakció is lejátszódhat.
A polimerizáció olyan folyamat, amely során egy telítetlen
vegyület sok azonos molekulával egyesülve alkot egy óriásmolekulát .
A legegyszerűbb alkén, az etén (etilén) polimerizációjával állítják elő a
polietilént, amely a műanyaggyártás egyik alapanyaga.
Előfordulásuk: az élő természetben sokféle olefin
fordul elő. Ezek viszonylag bonyolult szerkezetű, nagyobb szénatomszámú vegyületek.
Előállításuk: az olefineket paraffinok hőbontásával
(krakkolás) állítják elő.
Felhasználás: műanyaggyártás
Kiegészítés:* ismeretesek olyan telítetlen szénhidrogének,
amelyek szénláncában több kettős kötés található. Ezek közé tartozik a butadién,
az izoprén, amely sok természetes szénvegyület alkotója. Többek közt
izoprénrészekből épülnek fel növényi színanyagok (karotin, likopin), valamint
a gumigyártás alapjául szolgáló kaucsuk.
1.2.2. Telítetlen szénhidrogének - alkinek
Az alkinek olyan szénhidrogének, melyek háromszoros kovalens
kötést tartalmaznak.
Elnevezés: az alkinek neve -in szótagra
végződik.
Az alkinek legegyszerűbb képviselője az etin (acetilén).
1.2.2.1. Acetilén
Fizikai tulajdonságai: színtelen, szagtalan, szobahőmérsékleten
gáz. Vízben gyengén, acetonban (szerves oldószer) jól oldódik.
Kémiai tulajdonságai: a háromszoros kovalens kötés
kialakításában egy szigma és két pi-elektronpár vesz részt. A második pi-elektronpár
a szigmakötés síkja előtt és mögött helyezkedik el. A háromszoros kötés miatt
a szénatomok közötti távolság kisebb, mint az eténben. A kis helyre összezsúfolt
pi-elektronpárok azonban bizonyos mértékig taszítják egymást, így a távolabb
vannak a szénatomtörzsektől, mint az etén esetében.
Az acetilén kormozó lánggal ég, addíciós reakciókra hajlamos. Ezek közül
igen jelentős az acetilén és a hidrogén-klorid egyesülése, mert a keletkező
vinil-klorid polimerizált formája (poli-vinil-klorid) a legismertebb műanyag.
Előállításuk: kalciumkarbidból vízzel: CaC2
+ 2H2O = C2H2 + Ca(OH)2 ez a reakció
játszódik le a karbidlámpákban is.
1.3. Aromás szénhidrogének*
Az aromás jelző olyan molekulaszerkezetet jelöl, amelyben gyűrűsen delokalizált,
stabilis pi-elektronrendszer van. Legegyszerűbb képviselőik a benzol.
1.3.1. Benzol
 Fizikai
tulajdonságai: színtelen, jellegzetes szagú folyadék.
Fizikai
tulajdonságai: színtelen, jellegzetes szagú folyadék.
Kémiai tulajdonságai: vízzel nem elegyedik, kormozó
lánggal ég, addíciós reakcióra NEM, szubsztitúciós reakcióra hajlamos. A benzol
szerkezetét az ábra segítségével tanári magyarázattal sajátíthatod el.
1.4. Halogénezett szénhidrogének
A halogénezett szénhidrogének - ahogy nevük is mutatja - a szén és hidrogén
atomon kívül valamilyen halogénatomot (F, Cl, Br, I) is tartalmaznak. Jelentősebb
képviselőiket az alábbi táblázat szemlélteti.
Triviális név |
Tudományos név |
Összegképlet |
Tulajdonság |
Felhasználás |
kloroform |
triklórmetán |
CHCl3 |
kellemes szagú, színtelen folyadék, amely vízben
nem, csak szerves oldószerekben oldódik |
kitűnő oldószer, belélegezve narkotikus hatású (májkárosodás,
szívbénulás) |
freon-12 |
difluor-diklórmetán |
CF2Cl2 |
színtelen, szagtalan, nagy párolgáshőjű gáz |
hűtőgépek hűtőfolyadéka, hajtógáz |
szén-tetraklorid |
tetraklórmetán |
CCl4 |
színtelen, kellemes szagú, mérgező, éghetetlen folyadék |
kitűnő oldószer, zsíroldó |
etil-klorid |
klóretán |
C2H5Cl |
színtelen, kellemes szagú gáz |
gyógyászatban helyi érzéstelenítésre (sportsérülések) |
vinil-klorid |
klóretén |
C2H3Cl |
színtelen, szagtalan, mérgező gáz |
polimerizációjával a PVC alapanyaga |
triklóretilén |
1,1,2-triklóretén |
C2HCl3 |
színtelen, nem gyúlékony folyadék |
ipari oldószer |
tetrafluoretilén |
1,1,2,2-tetrafluoretén |
C2F4 |
színtelen, szagtalan, gyúlékony gáz |
polimerizációjával állítják elő a teflont |
 1. Nézzetek
utána az alábbi szerek tulajdonságainak: DDT, HCH, globol, dioxin! Mi közük
van a halogénezett szénhidrogénekhez?
1. Nézzetek
utána az alábbi szerek tulajdonságainak: DDT, HCH, globol, dioxin! Mi közük
van a halogénezett szénhidrogénekhez?
 Mit ír az SDT a..
telítetlen
szénhidrogénekről, az aromás
szénhidrogénekről, a halogénezett
szénhidrogénekről?
Mit ír az SDT a..
telítetlen
szénhidrogénekről, az aromás
szénhidrogénekről, a halogénezett
szénhidrogénekről?
 telített szénhidrogén,
telítetlen szénhidrogén, nyílt láncú, gyűrűs, szubsztitúció, oxidáció, csoport,
konstitúció, konstitúciós izomer, alkén, olefin, szigma-kötés, pi-kötés, geometriai
izomer, addíció, polimerizáció
telített szénhidrogén,
telítetlen szénhidrogén, nyílt láncú, gyűrűs, szubsztitúció, oxidáció, csoport,
konstitúció, konstitúciós izomer, alkén, olefin, szigma-kötés, pi-kötés, geometriai
izomer, addíció, polimerizáció
rendűség, térizomer (sztereoizomer), transz-izomer, cisz-izomer, aromás
szénhidrogének , delokalizált elektronfelhő,
 1.
Sorold fel az első tíz alkánt, ad meg szerkezeti- és összegképletüket!
1.
Sorold fel az első tíz alkánt, ad meg szerkezeti- és összegképletüket! Érdemes
meglátogatnod az alábbi oktatási oldalakat!
Érdemes
meglátogatnod az alábbi oktatási oldalakat! Abban
az esetben, ha a szénlánc gyűrűvé záródik a szénhidrogénlánc neve elé illesztjük
a ciklo szócskát. Pl.: ciklopropán, ciklobután...
A képen a ciklohexán látható. Sok olyan természetes és mesterséges vegyületet
ismerünk, amelynek molekuláiban a szénatomok többgyűrűs vázat alkotnak. Ezek
közül most a szteroidokat említjük meg, melyek közös "alapvegyülete"
a szteránváz (más néven gonán).
Abban
az esetben, ha a szénlánc gyűrűvé záródik a szénhidrogénlánc neve elé illesztjük
a ciklo szócskát. Pl.: ciklopropán, ciklobután...
A képen a ciklohexán látható. Sok olyan természetes és mesterséges vegyületet
ismerünk, amelynek molekuláiban a szénatomok többgyűrűs vázat alkotnak. Ezek
közül most a szteroidokat említjük meg, melyek közös "alapvegyülete"
a szteránváz (más néven gonán).  Kémiai
tulajdonságaik: a két kovalens kötés közül az egyik pontosan
a szénatomok között található (szigma-kötés), a másik a szigma-váz
síkja alatt és fölött helyezkedik el (pi-kötés). Utóbbi erőssége a szigmáénál
valamivel gyengébb, így könnyen reakcióba hozható. Ennek megfeleleően az alkének
reakcióképesebbek, mint az alkánok.
Kémiai
tulajdonságaik: a két kovalens kötés közül az egyik pontosan
a szénatomok között található (szigma-kötés), a másik a szigma-váz
síkja alatt és fölött helyezkedik el (pi-kötés). Utóbbi erőssége a szigmáénál
valamivel gyengébb, így könnyen reakcióba hozható. Ennek megfeleleően az alkének
reakcióképesebbek, mint az alkánok. 
 Fizikai
tulajdonságai: színtelen, jellegzetes szagú folyadék.
Fizikai
tulajdonságai: színtelen, jellegzetes szagú folyadék.  telített szénhidrogén,
telítetlen szénhidrogén, nyílt láncú, gyűrűs, szubsztitúció, oxidáció, csoport,
konstitúció, konstitúciós izomer, alkén, olefin, szigma-kötés, pi-kötés, geometriai
izomer, addíció, polimerizáció
telített szénhidrogén,
telítetlen szénhidrogén, nyílt láncú, gyűrűs, szubsztitúció, oxidáció, csoport,
konstitúció, konstitúciós izomer, alkén, olefin, szigma-kötés, pi-kötés, geometriai
izomer, addíció, polimerizáció