A kezdés kicsit furcsának tűnhet. Miért pont az edényekkel kezdjük. A válasz egyszerű, azért mert próbálunk az egyszerűbb kémiai anyagoktól a bonyolultabbak felé haladni, ráadásul nem is az edényekkel, hanem az egyéb berendezésekkel kezdjük, konkrétan a tűzhellyel és a hűtőszekrénnyel.
Az energia epochában, mint már említettük tanultál a szénhidrogénekről, de az energia takarékosságról is. Megtanultad, hogy a gáztűzhelyek hatásfoka sokkal jobb, mint a villanyoké, ha takarékoskodni akarsz, minél kevesebb elektromos melegítő berendezést használj (pl. vízforraló). De mi is jön a gáztűzhelyből? Erre két lehetőség adódik, vagy vezetékes gázzal működik, vagy gázpalackkal. Előbbi esetben metán és etán, utóbbi esetben propán és bután az energiaforrás. Ha egy kicsit kémiásabbá vesszük a formát már is le tudod írni a telített szénhidrogének bizonyos tulajdonságait.
Telített szénhidrogének (más néven alkánok, paraffinok)
Fizikai tulajdonságaik:
szénatomszám |
szín |
szag |
halmazállapot |
1-4 |
|||
5-18 |
|||
19 felett |
Kémiai tulajdonságaik:
 1. A telített
szénhidrogének elégethetőek, égésük során víz és szén-dioxid keletkezik.
A folyamatot, mint tudod oxidációnak nevezzük.
1. A telített
szénhidrogének elégethetőek, égésük során víz és szén-dioxid keletkezik.
A folyamatot, mint tudod oxidációnak nevezzük.
CH4 + 2O2 = CO2 + 2H2O
2. Természetesen oxigénen kívül más molekulákkal is reakcióba lépnek. Azonban annak megfelelően, hogy elektronszerkezetük nagyon kiegyensúlyozott, sem elektronhiányuk, sem elektromfeleslegük nincs a molekulán belül, nem túl reakcióképes vegyületek. A metán ultraibolya fény hatására reagál halogénekkel. Egyik hidrogénjét halogénre cseréli.
CH4 + Cl2 = CH3Cl + HCl
A kémiai átalakulás neve: szubsztitúció. Az olyan kémiai átalakulásokat, amelyek eredményeként a kiindulási molekula egyik atomja vagy atomcsoportja más atomra vagy atomcsoportra cserélődik ki szubsztitúciónak nevezzük.
3. A folyékony halmazállapotú szénhidrogénekre gondolva, pedig könnyen belátod, hogy a paraffinok vízben gyakorlatilag nem oldódnak.
Előfordulásuk: földgáz, kőolaj
Felhasználásuk: energiaforrások
Kiegészítés:* a szénláncok elágazásokat, oldalláncokat is tartalmazhatnak. Tulajdonságaik megismerése előtt szükséges a csoport fogalmának megismerése, amely így hangzik: a mulekula általunk tetszőlegesen körülhatárolt egy-egy részlete. Ha a csoport csak egy hidrogénatommal tartalmaz kevesebbet, mint egy alkánmolekula, akkor úgy nevezzük el, hogy az azonos szénatomszámú alkán nevének -án végződését -il végződéssel helyettesítjük. Pl: metil-csoport -CH3.
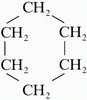
Két vagy három szénatom csak egyféleképpen kapcsolódhat lánccá, négy szénatom kapcsolódására azonban már két lehetőség van. Az azonos összegképletű, de különböző szerkezetű molekulákat egymás konstitúciós izomerjeinek nevezzük. (A molekulát felépítő atomok kapcsolódási sorrendjét a molekula konstitúciójának nevezzük.) Nézzük meg a jelenséget a bután példáján! Ha nem ágazik el a szénlánc a vegyület neve: bután, ha közepén van egy elágazás izomerje a butánnak, elnevezése: izobután.
Balra bután, jobbra izobután. |
 Abban
az esetben, ha a szénlánc gyűrűvé záródik a szénhidrogénlánc neve elé illesztjük
a ciklo szócskát. Pl.: ciklopropán, ciklobután...
A képen a ciklohexán látható. Sok olyan természetes és mesterséges vegyületet
ismerünk, amelynek molekuláiban a szénatomok többgyűrűs vázat alkotnak.
Ezek közül most a szteroidokat említjük meg, melyek közös "alapvegyülete"
a szteránváz (más néven gonán).
Abban
az esetben, ha a szénlánc gyűrűvé záródik a szénhidrogénlánc neve elé illesztjük
a ciklo szócskát. Pl.: ciklopropán, ciklobután...
A képen a ciklohexán látható. Sok olyan természetes és mesterséges vegyületet
ismerünk, amelynek molekuláiban a szénatomok többgyűrűs vázat alkotnak.
Ezek közül most a szteroidokat említjük meg, melyek közös "alapvegyülete"
a szteránváz (más néven gonán).
Ha telített szénhidrogének léteznek, akkor nyílván léteznek telítetlenek is. Ezekkel egy részével is találkozunk a konyhában, de bonyolultságuk miatt csak később tárgyaljuk őket. Itt csak általánosan jellemezzük a csoportot.
Telítetlen szénhidrogének
Telítetlen szénhidrogéneknek két csoportját ismerjük meg, az alkéneket és az alkineket.
Telítetlen szénhidrogének - alkének
 Az alkének
(olefinek) olyan szénhidrogének melyek legalább egy kettős kötést tartalmaznak.
Egyik legfontosabb tulajdonságuk a műanyaggyártásban betöltött jelentőségük.
Az alkének
(olefinek) olyan szénhidrogének melyek legalább egy kettős kötést tartalmaznak.
Egyik legfontosabb tulajdonságuk a műanyaggyártásban betöltött jelentőségük.
Elnevezés: az alkének neve -én szótagra végződik.
Fizikai tulajdonságaik: az alkánokhoz hasonló tulajdonságúak, hisz az alkének is apolárisak.
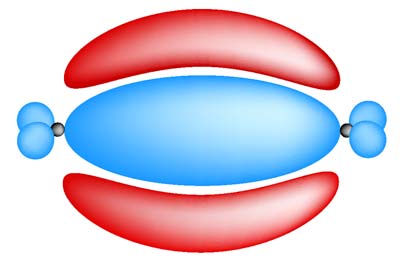 |
Kémiai tulajdonságaik: a
két kovalens kötés közül az egyik pontosan a szénatomok között található
(szigma-kötés), a másik a szigma-váz síkja alatt
és fölött helyezkedik el (pi-kötés). Utóbbi erőssége a szigmáénál
valamivel gyengébb, így könnyen reakcióba hozható. Ennek megfeleleően
az alkének reakcióképesebbek, mint az alkánok. |
 A pi kötésnek
köszönhetően a szénatomok közötti kötéstengelymenti csavarodása nem lehetséges,
a csoportok viszonylagos helyzete rögzített. A jelenséget geometriai
izomérianak nevezzük.
A pi kötésnek
köszönhetően a szénatomok közötti kötéstengelymenti csavarodása nem lehetséges,
a csoportok viszonylagos helyzete rögzített. A jelenséget geometriai
izomérianak nevezzük.
Égésük tökéletlen, tehát kormozó lánggal égnek. ![]()
A kettős kötés miatt ún. addíciós reakcióra hajlamosak. Az addíció olyan reakció, amelyben két molekula melléktermék nélkül egyesül. Ábrán hidrogén- és halogénaddíció.
![]()

Megfelelő katalizátor hatására polimerizáós reakció is lejátszódhat.
 A polimerizáció
olyan folyamat, amely során egy telítetlen vegyület sok azonos
molekulával egyesülve alkot egy óriásmolekulát .
A polimerizáció
olyan folyamat, amely során egy telítetlen vegyület sok azonos
molekulával egyesülve alkot egy óriásmolekulát .![]()
A legegyszerűbb alkén, az etén (etilén) polimerizációjával állítják elő a polietilént, amely a műanyaggyártás egyik alapanyaga.
Előfordulásuk: az élő természetben sokféle olefin fordul elő. Ezek viszonylag bonyolult szerkezetű, nagyobb szénatomszámú vegyületek.
 Előállításuk:
az olefineket paraffinok hőbontásával (krakkolás) állítják elő.
Előállításuk:
az olefineket paraffinok hőbontásával (krakkolás) állítják elő.
Felhasználás: műanyaggyártás
Kiegészítés:* ismeretesek olyan telítetlen szénhidrogének, amelyek szénláncában több kettős kötés található. Ezek közé tartozik a butadién, az izoprén, amely sok természetes szénvegyület alkotója. Többek közt izoprénrészekből épülnek fel növényi színanyagok (karotin, likopin), valamint a gumigyártás alapjául szolgáló kaucsuk.
Telítetlen szénhidrogének - alkinek
Az alkinek olyan szénhidrogének, melyek háromszoros kovalens kötést tartalmaznak.
Elnevezés: az alkinek neve -in szótagra végződik.
Az alkinek legegyszerűbb képviselője az etin (acetilén).
Acetilén
Fizikai tulajdonságai: színtelen, szagtalan, szobahőmérsékleten gáz. Vízben gyengén, acetonban (szerves oldószer) jól oldódik.
Kémiai tulajdonságai: a háromszoros kovalens kötés kialakításában egy szigma és két pi-elektronpár vesz részt. A második pi-elektronpár a szigmakötés síkja előtt és mögött helyezkedik el. A háromszoros kötés miatt a szénatomok közötti távolság kisebb, mint az eténben. A kis helyre összezsúfolt pi-elektronpárok azonban bizonyos mértékig taszítják egymást, így a távolabb vannak a szénatomtörzsektől, mint az etén esetében.
 Az acetilén kormozó
lánggal ég, addíciós reakciókra hajlamos. Ezek közül igen jelentős az acetilén
és a hidrogén-klorid egyesülése, mert a keletkező vinil-klorid polimerizált
formája (poli-vinil-klorid) a legismertebb műanyag.
Az acetilén kormozó
lánggal ég, addíciós reakciókra hajlamos. Ezek közül igen jelentős az acetilén
és a hidrogén-klorid egyesülése, mert a keletkező vinil-klorid polimerizált
formája (poli-vinil-klorid) a legismertebb műanyag.
Előállításuk: kalciumkarbidból vízzel: CaC2 + 2H2O = C2H2 + Ca(OH)2 ez a reakció játszódik le a karbidlámpákban is.
Aromás szénhidrogének*
Az aromás jelző olyan molekulaszerkezetet jelöl, amelyben gyűrűsen delokalizált, stabilis pi-elektronrendszer van. Legegyszerűbb képviselőik a benzol.
Benzol
 Fizikai
tulajdonságai: színtelen,
jellegzetes szagú folyadék.
Fizikai
tulajdonságai: színtelen,
jellegzetes szagú folyadék.
Kémiai tulajdonságai: vízzel nem elegyedik, kormozó lánggal ég, addíciós reakcióra NEM, szubsztitúciós reakcióra hajlamos. A benzol szerkezetét az ábra segítségével tanári magyarázattal sajátíthatod el.
Halogénezett szénhidrogének
 A halogénezett
szénhidrogének - ahogy nevük is mutatja - a szén és hidrogén atomon kívül
valamilyen halogénatomot (F, Cl, Br, I) is tartalmaznak. Halogénezett szénhidrogén,
a freon-12 fontos szerepet tölt be a konyhában, hűtőfolyadékként funkcionál
a hűtőszekrényben. Ezen kívül számos egyéb halogénszármazék is előfordul
a konyhában, ezeket zsíroldószerként, illetve edényeink bevonószereiként
(teflon) használjuk. Szintén halogénezett szénhidrogént alkalmaznak a légkondicionáló
berendezések működéséhez.
A halogénezett
szénhidrogének - ahogy nevük is mutatja - a szén és hidrogén atomon kívül
valamilyen halogénatomot (F, Cl, Br, I) is tartalmaznak. Halogénezett szénhidrogén,
a freon-12 fontos szerepet tölt be a konyhában, hűtőfolyadékként funkcionál
a hűtőszekrényben. Ezen kívül számos egyéb halogénszármazék is előfordul
a konyhában, ezeket zsíroldószerként, illetve edényeink bevonószereiként
(teflon) használjuk. Szintén halogénezett szénhidrogént alkalmaznak a légkondicionáló
berendezések működéséhez.
Triviális név |
Tudományos név |
Összegképlet |
Tulajdonság |
Felhasználás |
kloroform |
triklórmetán |
CHCl3 |
kellemes szagú, színtelen folyadék,
amely vízben nem, csak szerves oldószerekben oldódik |
kitűnő oldószer, belélegezve narkotikus
hatású (májkárosodás, szívbénulás) |
freon-12 |
difluor-diklórmetán |
CF2Cl2 |
színtelen, szagtalan, nagy párolgáshőjű
gáz |
hűtőgépek hűtőfolyadéka, hajtógáz |
szén-tetraklorid |
tetraklórmetán |
CCl4 |
színtelen, kellemes szagú, mérgező,
éghetetlen folyadék |
kitűnő oldószer, zsíroldó |
etil-klorid |
klóretán |
C2H5Cl |
színtelen, kellemes szagú gáz |
gyógyászatban helyi érzéstelenítésre
(sportsérülések) |
vinil-klorid |
klóretén |
C2H3Cl |
színtelen, szagtalan, mérgező
gáz |
polimerizációjával a PVC alapanyaga |
triklóretilén |
1,1,2-triklóretén |
C2HCl3 |
színtelen, nem gyúlékony folyadék |
ipari oldószer |
tetrafluoretilén |
1,1,2,2-tetrafluoretén |
C2F4 |
színtelen, szagtalan, gyúlékony
gáz |
polimerizációjával állítják elő
a teflont |
A légkör epochából talán emlékszel arra, hogy a halogénezett szénhidrogének súlyos környezetszennyezést jelentenek, ugyan is károsítják az ózonpajzsot.
 2.1.
Nézz utána az alábbi szerek tulajdonságainak: DDT, HCH, globol,
dioxin! Mi közük van a halogénezett szénhidrogénekhez?
2.1.
Nézz utána az alábbi szerek tulajdonságainak: DDT, HCH, globol,
dioxin! Mi közük van a halogénezett szénhidrogénekhez?
2.2. Elevenítsd fel az ózonpajzsról, annak vékonyodásáról és a védelméről
tanultakat! Lehetőleg milyen hűtőszekrényt vásárolj?
2.3. Rendszerezzük a szénhidrogének csoportjait!
A szénhidrogének lehetnek: 1. telítettek - ez azt jelenti, hogy a szénatomok közt csak egyszeres
kovalens kötés alakul ki A szénhidrogének lehetnek: 1. nyílt láncúak - ez esetben nem alalkul ki gyűrű A szénhidrogének tartalmazhatnak más atomokat (hidrogénen és szénen kívül), vagy atomcsoportokat: 1. halogénezett szénhidrogének és a későbbiekben tanulsz a következőkről: 2. oxigéntartalmú szénvegyületek |
 Mit
ír az SDT a telítetlen
szénhidrogénekről, az aromás
szénhidrogénekről, a halogénezett
szénhidrogénekről?
Mit
ír az SDT a telítetlen
szénhidrogénekről, az aromás
szénhidrogénekről, a halogénezett
szénhidrogénekről?
A hűtőszekrényről, a gáztűzhelyről, a légkondicionálókról és a műanyag edényekről már esett szó. Most nézzük meg milyen edényeket használnak még a konyhában!
Alumíniumedények
 Az alumíniumedények
nem a szerves vegyületek közé tartoznak, alapanyaguk egy fém, az alumínium.
Számos jó tulajdonsággal bírnak, pl. könnyen tiszíthatók, nem rozsdásodnak
és a hőt is jobban vezetik, így használatuk energiatakarékos. Az alumínium
előállításáról már korábban tanultál, ha gondolod itt
átismételheted. Néhány jó tanácsot azonban hagy említsünk:
Az alumíniumedények
nem a szerves vegyületek közé tartoznak, alapanyaguk egy fém, az alumínium.
Számos jó tulajdonsággal bírnak, pl. könnyen tiszíthatók, nem rozsdásodnak
és a hőt is jobban vezetik, így használatuk energiatakarékos. Az alumínium
előállításáról már korábban tanultál, ha gondolod itt
átismételheted. Néhány jó tanácsot azonban hagy említsünk:
- Savanyú ételt ne főzzünk alumíniumedényben (se alufóliában),
mert a benne található savak kioldják az edény falából a fémet. Az alumínium
feltételezések szerint hozzá járul az Alzheimer-kór kialakulásához.
- Az alumínium felületére a vízkő könnyen kicsapódik. Ezért időnként tanácsos
a vízkőtől is megtisztítani. A hozzáférhető helyen lévő vékony követ súrolással
távolítsuk el, a vastagabb vagy nehezen elérhető réteget vízkőoldóval oldjuk
le.
- Alumínium edényt csak forralással és fertőtlenítő hatású mosószerrel tisztítsunk.
Lúgos mosószert ne használjunk, mert a lúg a fémet megtámadja. Ezért ajánlatos
a többi, zománcozott edénytől elkülönítve mosogatni.
- Ha az edény nagyon zsíros, előbb újságpapírral töröljük le, majd mosószeres
vízben mosogassuk el. Meleg vízzel öblítsük. Amennyiben az edényt sikálnunk
kell, használjunk finom fémgyapotot vagy súrolóanyagot. Durva kőporral sohase
tisztítsuk, és késsel se próbáljuk levakarni a szennyeződéseket.
- Ha az edény foltos lesz, főzzünk benne gyümölcsöt vagy almahéjat. Az alumínium
felületéről a foltok eltűnnek. Ha viszont az edény megszürkült, félbevágott
citrommal dörzsöljük fényesre. A nyers paradicsomtól is megtisztul.
 Az
Alzheimer-kórral kapcsolatos linkek 1.,
2., 3.
Az
Alzheimer-kórral kapcsolatos linkek 1.,
2., 3.
Az
alumíniumgyártás
Dal az alumíniumedényről
Zománcedények
 A zománcedények
alapját az acél (edzett vas) képezi, amelyet zománcréteggel vonnak be. De
mi is az a zománc? Akármilyen meglepően hangzik is, a zománc valójában üveg.
A porrá tört és fémoxidokkal színezett üveget víz, továbbá réz és gyanta
(vagy más emulziók) segítségével viszik fel a bevonandó felületre, amely
fém mellett, üvegre és porcelánra is lehet. A zománc, akárcsak az üveg,
több ezer éves múltra tekint vissza. És, amit nem árt még tudni:
A zománcedények
alapját az acél (edzett vas) képezi, amelyet zománcréteggel vonnak be. De
mi is az a zománc? Akármilyen meglepően hangzik is, a zománc valójában üveg.
A porrá tört és fémoxidokkal színezett üveget víz, továbbá réz és gyanta
(vagy más emulziók) segítségével viszik fel a bevonandó felületre, amely
fém mellett, üvegre és porcelánra is lehet. A zománc, akárcsak az üveg,
több ezer éves múltra tekint vissza. És, amit nem árt még tudni:
- Ne főzzünk sérült, lepattogzott zománcedényben, de olyanban
sem, amelyikben az étel károsodik, vagy amelyből káros anyagok juthatnak
bele.
- Mosogatás után lehetőleg ne törölgessük az edényeket, mert a törlőruhával
baktériumokat és szöszöket viszünk az edényre!
Energiatakarékossági szempontokból fontos, hogy...
- lehetőleg alacsony, széles edényben főzzünk! A láng így
nagyobb felületen éri az edényt, jobb a hőátadás és kevesebb gáz kell.
- a forrásban lévő ételt tartalmazó edényre hasonló
nagyságú edényt helyezhetünk, amiben lassú párolást igénylő étel készülhet.
Így külön gázfogyasztás nélkül is készíthetünk, melegen tarthatunk ételt.
A ?toronyfőzéssel? sok gáz takarítható meg.
- a gáz- vagy villanytűzhelyen az edény alja lehetőleg ne lógjon le a főzőlapról,
ill. a gázláng ne érjen túl a rátett edény alján. Edényeinket sohase tegyük
erős tűzre, és ne engedjük nagyon lefőni bennük az ételt.
 Zománc
Zománc
A zománcedény rétegei (kép)
Üvegedények
Edényeink negyedik legnagyobb csoportja üvegből készül. Az üveggyártás legkorábbi nyomai Mezopotámiából, kr. e. 1550-ből származnak. Általánosan elfogadott elmélet, hogy innen került az iparág Egyiptomba, ahol kr. e. 1500 körül jelent meg. Előállításához homok vagy kvarc (SiO2), szóda (Na2CO3) vagy hamuzsír (K2CO3) szükséges, amelyeket magas hőmérsékleten összeolvasztanak. Ezek mellett még számtalan más vegyületet is használnak adalékanyagnak, illetve az üveg tulajdonságának alakításához.
A szílicumról korábban még nem tanultál. A periódusos rendszer negyedik főcsoportjában, a szén alatt elhelyezkedő elem, amely szürke, rideg, fémesen csillogó, kemény anyag. Kristálya a gyémánthoz hasonló, szobahőmérsékleten kevéssé reakcióképes, vízben nem oldódik. Természetben csak vegyület formájában található, a földkéreg második leggyakoribb eleme. Leggyakoribb vegyületei a szilikátok, róluk itt már tanultál, itt csak néhányat említünk meg: alumínium-szilikát (agyag), magnézium-szilikát (azbeszt), földpát, csillám, gránit.
Az üveggyártás története és technológiája nagyon messzire nyúlik vissza, a részletesebb tájékozódás kedvéért d meg az alábbi linkeket!
 Az
üveg története
Az
üveg története
Üveg és
üveggyártás
 2.4.
Nézz utána az alábbi üvegtípusoknak! Vízüveg, kvarcüveg, jénai, ólomüveg.
2.4.
Nézz utána az alábbi üvegtípusoknak! Vízüveg, kvarcüveg, jénai, ólomüveg.
2.5. Nézz utána hogyan készül a cserép, a porcelán, a csempe, a tégla
és a cement!
![]() telített
szénhidrogén, telítetlen szénhidrogén, nyílt láncú, gyűrűs, szubsztitúció,
oxidáció, csoport, konstitúció, konstitúciós izomer, alkén, olefin, szigma-kötés,
pi-kötés, geometriai izomer, addíció, polimerizáció, szilícium, szilikát
telített
szénhidrogén, telítetlen szénhidrogén, nyílt láncú, gyűrűs, szubsztitúció,
oxidáció, csoport, konstitúció, konstitúciós izomer, alkén, olefin, szigma-kötés,
pi-kötés, geometriai izomer, addíció, polimerizáció, szilícium, szilikát
rendűség, térizomer (sztereoizomer), transz-izomer, cisz-izomer, aromás szénhidrogének , delokalizált elektronfelhő