Kőzetek a "mikroszkóp" alatt
Az feltehetően mindenki számára egyértelmű, hogy a kőzetek szilárd halmazállapotú anyagok. Az azonban már keveseknek, hogy a szilárd anyagoknak két formája lehet. A kémiailag szilárd anyagok ún. kristályráccsal rendelkeznek (a szilárd anyagok többsége), a fizikailag szilárd anyagok kristályráccsal nem rendelkeznek, ún. amorf anyagok (üveg).
Ha egy nagyon nagy nagyítású mikroszkóppal megnéznénk a kőzeteket láthatóvá válna, hogy természetesen ők is kémiai alkotókból, atomokból, (molekulákból) vagy ionokból épülnek fel. Ezek a kémiai részecskék az ún. rácspontokban helyezkednek el, ott helyhez kötöttek, de helyükön rezgőmozgást végeznek. A rácspontokban lévő részecskéket különböző kölcsönhatások "rögzítik" helyükön, ezekről később még lesz szó. A részecskék által kialakított legkisebb egységet, amelyből a kristályrács felépül elemi cellának nevezzük.
A kristályrács rácspontjaiban különböző részecskék lehetnek: atom, molekula, ion, fématomtörzs. Ennek megfelelően megkülönböztetünk atom-, molekula-, ion- és fémrácsot.
Atomrács
Az atomrács esetében a rácspontban lévő atomokat ún. kovalens kötés tartja össze. A kovalens kötés egy kémiai kötés, amely két atom elektronfelhőjének átfedésével jön létre.
ISM. Mit jelentenek az alábbi kifejezések: atom, molekula, ion, atommag, elektronfelhő, proton, neutron, elektron, legkülső elektronhéj.
A kovalens kötést két példával illusztrálnánk. Első példánkban vegyünk két hidrogén atomot. A hidrogén atomoknak egy-egy legkülső elektronja van. Ha a két hidrogén atom megfelelő közelségbe kerül egymáshoz elektronfelhőjük először deformálódik, majd az egy-egy elektron egyetlen közös elektronpályára kerül, kialakítva a hidrogén molekulát.
Második példánkban két különböző atomot veszünk. Az egyik a hidrogén a másik a klór. A hidrogénnek egy, a klórnak hét legkülső elektronja van. A klór elektronjai arra törekednek (és minden más atomé is), hogy párosával legyenek (az emberek sem szeretnek egyedül lenni normális esetben). Hat elektron párban lesz (3 pár), egynek azonban nem lesz párja. Ha a hidrogén és a klór megfelelő közelségben kerül a hidrogén egyetlen és a klór egy párosítatlan elektronja kialakítja a kovalens kötést.
A kovalens kötésnek létezik kétszeres és háromszoros változata is.

A szerkezeti képletek segítségével magyarázzátok el a kétszeres és a háromszoros kovalens kötés kialakulásának mechanizmusát!
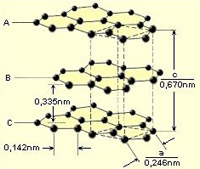
Tipikus atomrácsos elem a szén két módosulata a gyémánt és a grafit.
A gyémánt az egyik legkeményebb ismert anyag. A gyémánt atomrácsában a szénatomok egy piramisra emlékeztető alakban, ún. tetraéderesen helyezkednek el. Elektronjaik helyhez kötöttek (pontosabban a szénatomokhoz), nem tudnak elmozdulni, így az elektromos áramot nem vezeti. A grafit ún. rétegrácsos elem. A rétegek szénatomokbólépülnrk fel, amelyek egymással egy hatszög kialakításával kapcsolódnak. A rétegek közt csak gyenge kölcsönhatás van, így eltudnak csúszni egymáson. Ennek köszönhető, hogy a ceruza nyomot hagy a papíron. A grafit elektronjai kissé szabadabbak, így az elektromos áramot vezeti. Az atomrácsos anyagokra magas olvadás- és forráspont jellemző.
Molekularács
A molekularácsos anyagokat a kén molekula példáján szemléltetjük. A kén atomok 8 atomos molekulát képeznek, ezek (a nyolc atomból álló) molakulák lesznek a rácspontokban. A kén atomok között kovalens kötés van, a kénmolekulák között azonban csak gyengébb kötések. Melegítés hatására ezek a gyengébb kötések hamar felszakadnak és a molekula megolvad. Ezzel magyarázható a molekularácsos anyagok alacsony forrás- és olvadáspontja.
Amorf kén előállítása
Kémcsövet töltsünk meg kb. 1/3-ig kénporral, majd melegítsük.
Ionrács
Ionrács esetén a rácspontokban egyzserű, vagy összetett pozitív, illetve negatív ionok helyezkednek el. Az ionokat ionos kötés tartja össze, amely az ellentétes töltésű ionok vonzásának köszönhető. Egyszerű ionokból épül fel a nátrium-klorid (Na+, Cl- konyhasó) ionrácsa, a mészkő (kalcium-karbonát Ca2+, CO32-) ionrácsában azonban már összetett ion is van. Az ionok az atomokhoz hasonlóan jelentős vonzást gyakorolnak elektronjaikr, így ezek helyhez kötöttek. A következmény, hogy nem vezetik az elektromos áramot. Mivel az ionok töltéssel rendelkező részecskék, olvadék formájában már vezetők lesznek.
Fémrács
A fémrács rácspontjaiban olyan fématomok vannak, amelyek legkülső elektronjaikat leadták, így ún. pozitív fématomtörzzsé alakultak. A leadott elektronok nem helyhez kötöttek (delokalizáltak) ezért az áramot vezetik. A delokalizált elektronok fogják a rácsot összetartó fémes kötést kialakítani.
rácspont, elemi cella, kovalens kötés, atomrács, ionrács, molekularács, fémrács, ionos kötés, fémes kötés