Bevezetés a meteorológiába
3. Halmazállapot-változások
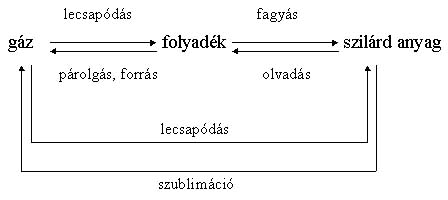
Az olvadás
Azt a halmazállapot-változást, amely közben a szilárd anyagok folyékonnyá válnak, olvadásnak nevezzük.
 |
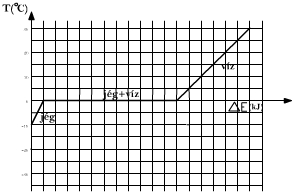
Tegyünk egy tál vízbe jeget tartalmazó főzőpoharat! Melegítsük a vizet! Ezáltal, a víz közvetítésével lassan növeljük a jég belső energiáját.. Kezdetben emelkedik a jég belső hőmérséklete, amikor azonban eléri a 0 Celsius fokot, hőmérséklete nem emelkedik tovább, hanem változatlan marad mindaddig, amíg a jég teljesen el nem olvad. Miután elolvad, a víz hőmérséklete tovább emelkedik.
Vannak olyan anyagok is, amelyek melegítéskor úgy válnak folyékonnyá, hogy közben melegszenek. Ezeknek nincs határozott olvadáspontjuk, ilyenek a zsír, üveg, viasz, enyv, stb
A következő táblázat azt mutatja, hogy mekkora hőmennyiség szükséges kül. tömegű
0 Celsius fok hőmérsékletű jégdarabok felolvasztásához
| Hőmennyiség (Q) | 680 kJ | 1360 kJ | 2040 kJ |
| Tömeg (m) | 2 kg | 4 kg | 6 kg |
| Hányadosuk | 340 kJ/kg | 340 kJ/kg | 340 kJ/kg |
Mint látjuk, a megolvasztáshoz szükséges hőmennyiség és a tömeg hányadosa
mindig ugyanakkora. Ez jellemző a jégre, úgy hívjuk : olvadáshő (jele: ![]() )
)
| Anyag | olvadáspont (Celsius fok) | olvadáshő (kJ/kg) |
| alkohol | -114 | 110 |
| arany | 1063 | 66 |
| higany | -39 | 10 |
| ólom | 327 | 25 |
| volfrám | 3350 | 189 |
 |
5.3.1. A 0,6 kg tömegű bronzdarab megolvasztása közben 32,4 kJ-lal nőtt belső energiája. Mekkora az olvadáshője?
 |
5.3.2. Lehet-e vaskanálban ólmot olvasztani, és ólomkanálban vasat? Indokold válaszodat az olvadáspont-táblázat adatai alapján!
A fagyás
Azt a halmazállapot-változást. amely közben a folyadék szilárddá válik, fagyásnak nevezzük.
Az olvadásnál megfigyelt jelenség itt is lejátszódik, csak foordítva. A hűtés közben, csökkentve a víz belső energiáját a következőket tapasztalhatjuk: kezdetben folyamatosan csökken a víz hőmérséklete, amikor azonban eléri a 0 Celsius fokot, hőmérséklete nem csökken tovább, hanem változatlan marad mindaddig, amíg a víz teljes egészében be nem fagy. Miután megfagy, a jég hőmérséklete tovább csökken.
 |
A két fázist egy bizonyos hőmérsékleten lépi át, ez a fagyáspont.
Ugyanannak az anyagnak az olvadáspontja megegyezik fagyáspontjával, ill. a
fagyáshő egyenlő az olvadáshővel.
Ebből adódóan a fagyáskor bekövetkező belsőenergia-változást is ugyanúgy számolhatjuk
ki, mint az olvadás következtében.
Fagyáskor a térfogat csökken, sűrűség nő, de van egy anyag, az egyik leggyakoribb a természetben, ami különlegesen viselkedik.
 |
Hőtágulásról, halmazállapotváltozásról itt , meg itt olvashatsz.
 |
A vízről
 |
Térfogata +4 Celsius fokon a legkisebb, amit úgy is mondhatunk, hogy ekkor a legsűrűbb. A természetben ez úgy jelentkezik, hogy amikor 4 fokosra hűl a víz, lesüllyed az állóvíz fenekére, és helyébe űjabb kerül. Ezért nem szoktak, csak a legnagyobb hidegben állóvizeink fenekükig befagyni.
Amint 4 Celsius fok alá csökken a hőmérséklete, nő a víz térfogata, és ez a térfogat-növekedés fagyás közben is folytatódik. A növekvő térfogatú jég igen nagy erő kifejtésére képes. Ez a fagyaprózódás, az egyik leggyakoribb kőzetformáló erő, különösen az olyan éghajlati területeken, ahol gyakran lépi át a fagyáspontot a hőmérséklet, ahol a sziklák repedéseibe kerülő víz megfagyva könnyedén darabolhatja fel a legnagyobb kőzetdarabokat is. Tehát nem a leghidegebb területekre jellemző aprózó erő ez, hanem a 0 Celsius fok körül gyakran változó régióké. Lehet ez zonális, de pl. a magasság miatt kialakuló hatás is. Emiatt látható télen pl. a Vörösmarty tér szoboregyüttesén a felfújható műanyag védőfólia, és ennek a hatásnak az eredménye a dolomit sziklák környezetét borító murva réteg is. A víz igen különleges anyag abból a szempontból, hogy szilárd állapotában nem süllyed le, ha saját, folyékony halmazállapotú közegébe helyezzük, hanem úszik rajta, ezt nevezzük a víz egyfajta fordított viselkedésének (lásd: jéghegyek).
Ha a vízbe más anyagot keverünk, módosíthatjuk fagyáspontját. Így a sós tengervíz fagyáspontja általában alacsonyabb, mint a tiszta víz fagyáspontja (-2,5 Celsius fok), de a 20 %-os konyhasóoldat fagyáspontja -18 Celsius fok. Ha más ásványi anyagokat vagy cukrot keverünk a vízbe is módosul a fagyáspont, így a vér és a növényi nedvek sem fagynak meg 0 fokon.