Bevezetés a meteorológiába
6. Gáztörvények
 |
Jótanács:mielőtt a gázokról elkezdünk részletesebben beszélni, érdemes megkeresned a korábbi anyagokból azokat a részeket, ahol a moláris mennyiségekkel, Avogadro-számmal foglalkoztunk!
A mechanikában egyes darabok, tárgyak mozgásával foglakoztunk, ami jelen esetben, amikor gázokról gondolkozunk nem lenne lehetséges, tehát be kell vezetnünk olyanokat, amelyek a gáz egészét írják le, összegezve az egyes részecskék hatását. Az ilyen fizikai jellemzőket állapotjelzőknek nevezzük.
Három állapotjelővel írjuk le a gáz fizikai állapotát, ezek a : nyomás, térfogat és a hőmérséklet. Rögzítenünk kell majd mindig valamelyiket, hogy közben a másik változásait tanulmányozhassuk.
 |
Ezzel a készülékkel a levegő nyomása és térfogata közötti összefüggést vizsgálhatjuk. Ha különböző nyomás alá helyezzük a gázt, figyelve közben térfogatváltozását, azt tapasztalhatjuk, hogy szorzatuk állandó marad.
Tehát adott gázmennyiség nyomása és térfogata úgy változhat csak állandó hőmérséklet esetén, hogy hogy a nyomás és a térfogat szorzata közben állandó marad. A törvényt gyakran úgy használjuk, hogy egy adott gázmennyiség két különböző állapotát hasonlítjuk össze, ha mindkét állapotban a hőmérséklet ugyanakkora.
A szobahőmérséklettől eltérő hőmérsékleten végzett kísérlet is hasonló eredményre vezet. Eltérő eredmény csak igen nagy nyomás esetén jelentkezik, de ritka gázok esetén nagy pontossággal teljesül.
 |
 |
Efféle vizsgálatokat végzett az 1600-as évek második felében Robert Boyle és Edme Mariotte, egymástól függetlenül, megközelítőleg egy időben. Ők fogalmazták meg a fenti törvényt, amely róluk kapta a Boyle-Mariotte nevet.
Most vizsgáljuk a gázok hőtágulását!
 |
 |
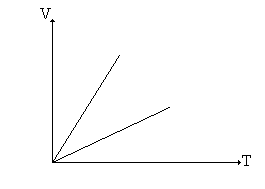
A jobb oldali képen látható úr Joseph-Louis Gay-Lussac (1778-1850) fogalmazta meg a következő gáztörvényt, amikor állandó nyomás mellett vizsgálta a gázok térfogatát úgy, hogy közben változtatta a gáz hőmérsékletét. A bal oldali grafikon mutatja, hogy egyenes arányosság mutatkozik a hőmérséklet és a térfogat közt, állandó nyomás mellett, abszolút hőmérsékleti skálát használva. A kapott egyenes arányosság azt jelenti, hogy állandó nyomás mellett a gáz térfogata és az abszolút hőmérséklet, azaz V/T állandó. Ha ugyanannak a gáznak két állapotát hasonlítjuk össze azonos nyomások esetén, akkor ezt így írhatjuk le:
Ezt a törvényt Gay-Lussac I. törvényének nevezzük
 |
 |
Gay-Lussac II. törvénye azt vizsgálja, hogyan változik a gáz nyomása a hőmérséklet függvényében, ha a gáz térfogatát állandóan tartjuk.
 |
5.6.2. Rajzolj egy kísérletet, amely a fenti törvényt támasztja alá, és a következőkből áll: borszeszégő, vasháromláb, azbesztháló, rajta főzőpohárban, vízben zárt lombik, összekötve nyomásmérővel!
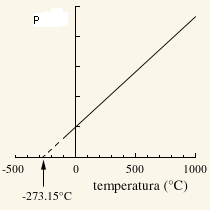
A kísérletet elvégezve azt tapasztalhatjuk, hogy ha a hőmérsékletet továbbra is Kelvin-skálával mérjük, akkor a nyomás egyenesen arányos a hőmérséklettel,tehát
feltéve, hogy a gáz mennyisége és térfogata állandó. Ha ugyanannak a gáznak két állapotát hasonlítjuk össze azonos térfogatok esetén, akkor ezt így írhatjuk le:
 |
A tisztesség kedvéért meg kell jegyeznünk, hogy tudomásunk szerint ezt a Gay-Lussac-nak tulajdonított törvényt előtte már ketten felfedezték: Jacques Alexandre Charles (1746-1823) francia fizikus és John Dalton (1766-1844) angol vegyész. Ezért pl. az angol nyelvű országokban ezeket a törvényeket Charles törvényeknek nevezik.
Most hozzávesszük a gáz állapotjelzői közé a gáz mennyiségét is (N). Vajon létezik-e olyan egyenlet, amely mind a négy közt kapcsolatot teremt? Ehhez foglaljunk először össze:
- A gáz nyomása egyenesen arányos a hőmérséklettel, ha a gáz térfogata és mennyisége nem változik, azaz P ~ T.
- Korábbi ismereteinkre támaszkodva kijelenthetjük, hogy a gáz nyomása egyenesen arányos a részecskeszámmal, ha a térfogat és a hőmérséklet állandó, tehát P ~ N.
- A gáz nyomása a Boyle-Mariotte törvény szerint fordítottan arányos a térfogattalha a hőmérséklet és a gáz mennyisége állandó, azaz P ~ 1 / V = állandó.
- A három összefüggést összefoglalva, a nyomás egyenesen arányos a hőmérséklet és a részecskeszám szorzatával, de fordítottan arányos a térfogattal: P ~ N * T / V
- Az egyenes arányosság miatt a két mennyiség hányadosa állandó:
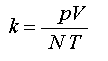 |
Az állandó neve Boltzmann-állandó (jele : k) Ludwig Eduard Boltzmann osztrák fizikus (1844-1906) után.Az állandó értékét meghatározhatjuk úgy is, hogy ismert mennyiségű gáz hőmérsékletét, térfogatát, nyomását megmérjük, és a mért adatokat behelyettesítjük a fenti összefüggésbe. Mivel a nyomást pascalban, a térfogatot köbméterben, a hőmérsékletet Kelvinben adjuk meg, ( a részecskeszámnak nincs mértékegysége), pontos mérések alapján a Boltzmann-állandó értéke és mértékegysége:
Az állandó helyére írjuk be a Boltzmann-állandót, és az egyenlet mindkét oldalát szorozzuk meg N*T-vel! Ekkor megkapjuk a gáz állapotegyenletét:
P * V=N * k * T
 |
5.6.3. Határozzuk meg, hány részecske van abban az oxigén gázban, amelyiknek nyomása
| Pa, térfogata 1 köbméter, és hőmérséklete 27 Celsius fok? |
 |
5.6.4. Ismétlés:egy pohár vízbe jégkockát dobunk, és megvárjuk, amíg elolvad. Milyen lesz a vízszint magassága az eredetihez képest? Csökken, változatlan marad, vagy nő?