A vas és az alumínium
A vas története
Sokáig úgy tűnt, hogy mindennapi életünk egyik leggyakrabban felhasznált féme, pontosabban annak ellátása az "istenek kegyétől" függ, hisz kr.e. 4200 és 2200 között csupán az égből hullott mennyei fémet, a meteorit eredetű vasat ismerték és használták fel. Az első biztosan nem meteorit eredetű vasfejsze kr.e. 2200-ból származik (Egyiptom, Abusir). Kr.e. 1300 környékén a vas még mindig ritka fémnek számít, erre utal többek közt, hogy Tutanhamon fáraó aranykései közt egy acélkést is találtak.
Miért számít ritka fémnek a vas? Nem tudják érceiből elő állítani? Ez feltehetően nem igaz, hisz a rézércekhez hasonló hőmérsékleten állítható elő és kr.e. 1300 környékén a bronzgyártás jelentős fejlettségett ért el. A probléma abban keresendő, hogy a vasércek olvasztásakor a kemencék alján, a rézércekkel ellentétben nem gyűlik össze egy jellegzetes, csillogó fényű fémolvadék. A kemencékben nyert színvas szivacsos szerkezetű, piszkos anyagra emlékeztető végtermék. A másik ok feltehetően az, hogy a vasércek a leggyakrabban földszerű anyagok, a többi fémérccel ellentétben, amelyek egy része már önmagában is fémfényű.
A vas tulajdonságai
A vas magas olvadáspontú, nagy sűrűségű fém. A levegő oxigénje és nedvessége hatására oxidálódik (rozsdásodik). A vas jól mágnesezhető, mágneses tulajdonságát a mágneses tér megszűnése után is megtartja, a jelenséget ferromágnesességnek nevezzük. A vas fontos, előnyös tulajdonsága, hogy izzó állapotban jól kovácsolható.
A vas híg savakkal reagál, tömény savakkal és lúgokkal nem lép reakcióba. További kémiai reakcióit a kísérletek közt találjátok.
1. Milyen ételekben található a szervezet számára hasznosítható vas?
A vasgyártás
A vasgyártás alapanyaga a vasérc és különböző segédanyagok (szén-koksz, salakképző anyag és levegő). A folyamat a nagyolvasztóban történik, ahol felülről adagolják a vasércet, a kokszot és salakképző anyagként mészkövet. A befúvott levegő a szénnel (koksz) reakcióba lép és szén-dioxid, majd szén-monoxid képződik. A keletkező szén-monoxid, illetve a szén a vasérccel reagálva elemi vasat és valamilyen szén-oxidot eredményez. A keletkező olvadt vas az ún. nyersvas, amely széntartalma (1,6-4%) miatt rideg, törékeny anyag. Az emlíett tulajdonságai miatt a nyersvas nem sok mindenre használható, ezért acélt gyártanak belőle. Az acélgyártás során a nyersvas széntartalmát 1,7 % alá csökkentik, valamint különböző ötvöző anyagokat adagolnak hozzá. A keletkező acél (az ötvözőelemektől függően) kemény, szívós, jól megmunkálható, korrózió- és saválló.
A vasgyártás kémiai folyamatai:
A befúvott levegő elégeti a szenet C + O2 = CO2 Magas hőmérsékleten az izzó szén reakcióba lép a szén-dioxiddal CO2 + C = 2CO A vasércet az izzó szén és a szén-monoxid redukálja ("oxigén elvonás") Fe2O3 + 3C = 2Fe + 3CO
Fe2O3 + 3CO = 2Fe + 3CO2
Legismertebb vasércek
Mágnesvasérc (magnetit) Fe3O4 Vörösvasérc (hematit) Fe2O3 Barnavasérc (limonit) Fe2O3 . n H2O Vaspát (sziderit) FeCO3 A vas előfordulása és felhasználása
A vas részaránya a földkéregben 4,7%, az alumínium után a második leggyakoribb fém. Feltehetően a Föld belső magja túlnyomó részben vasból áll, ezzel van összefüggésben, hogy elemi állapotú vas csak meteoritokban fordul elő. A vasvegyületek száma jelentős, több, mint 400 vasásványt ismerünk. Földünk legnagyobb vasérclelőhelyei: Brazília, Szovjetunió utódállamai, Kanada, Ausztrália, India.
A vas az egyik legfontosabb használati fém, ötvözeteit igen széleskörben hasznosítják.
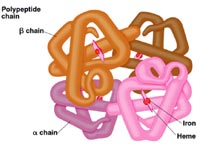
Magyarországi vasgyártás Vérszegénység
Az alumínium története
Az alumínium története jóval rövidebb, mint a vasé. Az alumínium elemi állapotban nem, csupán érceiben fordul elő. A legismertebb és leggyakoribb alumíniumérc a bauxit, amelyet csupán a XIX. században (1821) fedeztek fel a névadó Les Baux község (Dél-Franciaország) mellett. Érdekes módon az alumínium tulajdonságait már felfedezése előtt jól ismerték. A XIX. században elkészülő periódusos rendszerek a ma ismert elemek csupán töredékét tartalmazták, a hiányzó elemek tulajdonságai azonban a periódicitás miatt könnyen megjósolható volt. Így volt ez az alumíniummal is.
Felfedezését követően sem terjedhetett el gyorsan, hisz előállítása rendkívül költséges volt. Az 1855. évi párizsi világkiállításon bemutatott, hatalmas szenzációt keltő fém ára az aranyéval vetekedett (III. Napóleon számára evőeszközök, mellvért és más tárgyak készültek e különlegesen és drága fémből). A gazdaságos alumíniumgyártáshoz meg kellett várni az elektromos áram alkalmazását, hisz csupán ez tudott megfelelő energiát biztosítani a gazdaságos termeléshez.
Az alumínium tulajdonságai
Az alumínium ezüstfehér színű, jól megmunkálható fém. Kis sűrűsége miatt a könnyűfémek közé tartozik. Olvadáspontja nem túl magas, az elektromosságot jól vezeti.
Az alumínium felületén védő oxidréteg képződik így a levegőn nem korrodálódik (nem reagál az oxigénnel). Az oxidrétegétől megtisztított alumínium reagál a vízzel, védő réteg mellett is reakcióba lép savakkal és lúgokkal. További kémiai reakcióit a kísérletek közt találjátok.
Az alumínium az élőszervezetek számára nem létszükségletű elem. Sőt! Nagyobb mennyiségben mérgező lehet! Feltehetően összefüggés van az "alumíniummérgezés" és az Alzheimer-kór kialakulása között.
2. Nézzetek utána milyen betegség az Alzheimer-kór!
3. Jelöljétek a térképen hol bányásznak (bányásztak) hazánkban bauxitot!
Az alumíniumgyártás
Az alumíniumgyártásról korábban már tanultatok.
Az alumíniumgyártás (8. évfolyam okt.a.)
4. A linkek és CD-ROM segítségével elevenítsétek fel az alumíniumgyártásról tanultakat!
Az alumínium előfordulása és felhasználása
Az alumínium a földkéreg leggyakoribb eleme (részaránya 8,1%). Elemei állapotban nem, csak oxigénvagyületeiben (földpátok, csillám, timföld) fordul elő. Legfontosabb előfordulási helyei: Ausztrália, Guinea, Brazília, India, Indonézia, Kína, Kamerun.
Kis sűrűsége, jó elektromos és hővezetőképessége, korrózióállósága miatt igen széleskörben hasznosítják.
5. A képek segítségével nevezzétek meg az alumínium felhasználásának főbb területeit!