Tudjuk, hogy az áramköröknek tartalmaznia kell olyan berendezéseket, amelyek tartósan képesek elektromos mezőt fenntartani, és így tartósan elektromos áramot tudnak létrehozni. Ezeket a berendezéseket áramforrásoknak nevezzük. Ha az áramkörben csak az áramforráson kívül áramlanának a negatív töltéshordozók a negatív pólustól a pozitív felé, akkor a töltéskülönbség gyorsan kiegyenlítődne, és ez által az áram megszűnne. Mi azonban azt tapasztaljuk, hogy az izzó sokáig ugyanolyan erősségű fénnyel világít. Ez csak úgy magyarázható, hogy a negatív töltéshordozók áramlása az áramforráson belül is folytatódik, de itt már a pozitív pólustól a negatív felé, vagyis az elektromos mező erőhatásával szemben. Felmerül a kérdés, hogy honnan van ehhez energia? Ez általában valamilyen belső energia pl. kémiai energia.
Az egyik legelterjedtebb áramforrások a galvánelemek, amelyekben általában két különböző fém (elektród), valamilyen oldatba (elektrolit) merül. Az elektród és az elektrolit között kémiai reakció játszódik le, melynek hatására elektromos mező alakul ki.
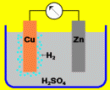 |
A kénsav vizes oldatába merített réz- és cinklemez
kémiai átalakuláson megy át, a jelenség eredményeként elektromos áramot
nyerünk. Ezt az elemet Volta-elemnek nevezzük. |
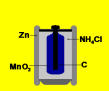 |
A ceruzaelem legkülső rétege cinkből készül,
belül szalmiáksó-oldat (elektrolit) és szénrúd helyezkedik el. Az
elemet feltalálójáról Leclanché-elemnek is nevezik (ejtsd:löklansé).
|
Az áramforrásnak azon kivezetését, amelyen elektrontöbblet van, negatív saroknak, másik kivezetését pozitív saroknak nevezzük.
 5.1.
Készítsetek rézszulfát-oldatot, majd helyezzetek bele vasszöget! Pár perc
elteltével vegyétek ki a szöget az oldatból, mit tapasztaltok?
5.1.
Készítsetek rézszulfát-oldatot, majd helyezzetek bele vasszöget! Pár perc
elteltével vegyétek ki a szöget az oldatból, mit tapasztaltok?
5.2. Írd fel a kristályos CuSO4 oldódásának egyenletét!
Tehát az oldatban Cu2+ és SO42- ionok vannak jelen. Amikor vasszöget helyeztünk az oldatba, azt tapasztaltuk, hogy réz vált ki. Ez csak úgy történhetett, hogy a réz-ionok valahonnan elektronokat kaptak. Addig nem történt változás még a szöget nem helyeztük az oldatba, tehát a vas atomok adtak át elektronokat a réz-ionoknak.
 5.3.
Az alábbi egyenleten jelöld az elektron átadást!
5.3.
Az alábbi egyenleten jelöld az elektron átadást!
Cu2+ + Fe ![]() Cu + Fe2+
Cu + Fe2+
Tehát a vas atomok elektronokat adtak le, azaz oxidálódtak, a réz-ionok elektronokat vettek fel, azaz redukálódtak. Az elektron átmenettel járó kémiai reakciókat redoxireakcióknak nevezzük.
Ha visszaemlékszel a kémiai kötéseknél tanultakra, akkor tudod, hogy nem minden esetben történik meg az elektron teljes mértékű átadása.
 5.4.
Hogyan alakul ki a HCl molekula? Rajzold fel a kiindulási anyagok és a keletkezett
anyag szerkezeti képletét egyaránt!
5.4.
Hogyan alakul ki a HCl molekula? Rajzold fel a kiindulási anyagok és a keletkezett
anyag szerkezeti képletét egyaránt!
H2 + Cl2 = 2 HCl
A hidrogén molekulákat és a klór molekulákat azonos minőségű atomok építik fel. Így a kötő elektronokat egyenlően osztják meg, egyenlően használják. Nincs névleges töltésük. A termék molekuláiban viszont különböző atomok kapcsolódnak egymáshoz. A klór elektronnegatívitása nagyobb, mint a hidrogéné, így a kötő elektonpárt alkotó elektronokat ő többet használja, ezért az elektronpárt névlegesen hozzárendeljük, azaz -1 lesz a névleges töltése. A töltésmegmaradás miatt a hidrogéné viszont +1. Nagyon fontos fogalomhoz, az oxidációs szám fogalmához jutottunk el ezzel a kis eszmefuttatással. Oxidációs szám valamely atom névleges vagy valódi töltésének számértéke. Így a redoxireakciók legáltalánosabb megfogalmazását is megadhatjuk. Minden olyan folyamat redoxireakciónak tekinthető, melyben oxidációsszám-változás történik.
 5.5.
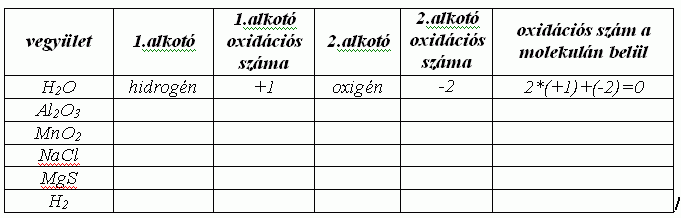
Írd fel az alábbi vegyületeket alkotó atomok oxidációs számát!
5.5.
Írd fel az alábbi vegyületeket alkotó atomok oxidációs számát!
Bármilyen redoxireakciót is vizsgálunk, benne valamely atom oxidációs száma csak akkor nőhet, ha van olyan atom is, amelynek csökken az oxidációs száma. Az oxidációsszám-változások összege zérus. Ennek a szabálynak a redoxiegyenletek rendezésekor igen nagy hasznát vesszük. Nézzünk egy példát!
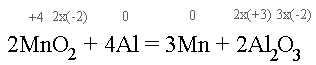
Az oxigénnek nem változott az oxidációs száma.
A mangánnak +4-ről 0-ra, azaz felvett 4 db elektront, redukálódott.
Az alumíniumnak 0-ról +3-ra, azaz leadott 3 db elektront. Látható, hogy
1:1-hez nem reagálhatnak, hiszen akkor megszegnék a töltésmegmaradás törvényét.
Így meg kell keresni a 3 és a 4 legkisebb közös többszörösét, ami 12. Ekkor
már teljesülni fog, hogy az egyik 12 elektront ad le a másik 12-t vesz fel.
A 3-at néggyel kell szorozni, tehát alumíniumból 4 kell, a mangánból pedig
három.
 5.6.
Gyakorlásként rendezd az alábbi egyenleteket!
5.6.
Gyakorlásként rendezd az alábbi egyenleteket!
CO + O2 = CO2
K + H2O = KOH + H2
Li + O2 = Li2O
Cr2O3 + Al = Al2O3 + Cr
P + O2 = P2O5
Az emberi vérben található alkohol közvetett kimutatására szolgáló eszközök az alkoholszonda. Egyszerű és gyors módszer a kilélegzett levegőt vizsgálni. Ennek alapja, hogy az elfogyasztott alkohol (változatlan formában) a véráramba kerül és a tüdő légcseréje során gőzei a kilélegzett levegőben is megjelennek. Az is fontos, hogy a kilélegzett levegő alkoholkoncentrációja arányos a vérben lévő koncentrációval, méghozzá annak 2100-ad része. (Vagyis 2100 ml kilélegzett levegő annyi alkoholt tartalmaz, mint 1 ml vér.) A kilélegzett levegő alkoholkoncentrációjának mérésére többféle eszköz alkalmas, amelyek mindegyike valamilyen kémiai reakció vagy fizikai jelenség alapján működik.
A "hagyományos" alkoholszonda (az ismert kis üvegcsövecske, amelyet már nem használnak) működési alapja az alábbi kémiai reakció:
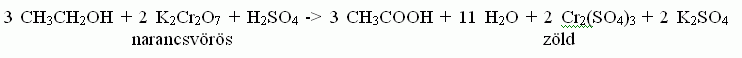
Vagyis az alkohol (CH3CH2OH) ecetsavvá (CH3COOH) történő oxidációja során a narancsvörös kálium-dikromát helyett zöld króm-szulfát jelenik meg, vagyis színváltozás történik és ez arányos a vérben lévő alkohol koncentrációjával.
 5.7.
Készítsetek elemet! Voltmérő segítségével mérjétek meg a két pólus a feszültséget!
5.7.
Készítsetek elemet! Voltmérő segítségével mérjétek meg a két pólus a feszültséget!
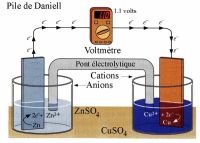 A
képen az ún. Daniell-elem felépítése látható (nagyítható)
A
képen az ún. Daniell-elem felépítése látható (nagyítható)
Amíg áram folyik a vezetékben, a réz kiválása és a cink oldódása is folyamatos. A kémiai folyamatok a következők:
Zn(sz) = Zn2+(aq) + 2 e- oxidáció
Cu2+(aq) + 2 e- = Cu(sz) redukció
A Daniell-elem negatív pólusa a cink, a pozitív pólusa a réz. Azt az elektródot, amelyen keresztül az áram kilép az oldatból, katódnak, a másik elektródot anódnak nevezzük. A katódon mindig redukció történik, az anódon mindig oxidáció.
![]() További
elemtípusok
További
elemtípusok
Ha az előbb mért feszültségnél valamivel nagyobb feszültség forrásra kapcsoljuk
a Daniell-elemünket akkor fordított folyamatok mennek végbe. Vagyis a réz
fog oldatba menni, a cink-ionok pedig ki fognak válni. Az elektromos áram
hatására most kémiai reakció megy végbe. Az így végbemenő folyamatok összességét
elektrolízisnek nevezzük.
![]() oxidációs
szám, redoxireakció, oxidáció, redukció, galvánelem, katód, anód
oxidációs
szám, redoxireakció, oxidáció, redukció, galvánelem, katód, anód