A különféle fűtőanyagoknál már említettük, hogy nem mindegy, milyen anyaggal fűtünk. Ha egy lábos vizet akarunk felmelegíteni, különböző mennyiségű fára, szénre, olajra vagy földgázra van szükségünk. Mindez természetesen amiatt van, hogy a különféle anyagok égése közben különböző nagyságú energia szabadul fel. Ezt az energiát természetesen Joule-ban mérhetjük. A kémiai folyamatok energiaváltozásának mennyiségi leírásával a termokémia foglalkozik.
Jogos kérdés, hogy miként fejezhetjük ki a legjobban az égéshőt. A földgáz égéshője 54 MJ/kg, míg a feketekőszéné csak 38 MJ/kg. Ha viszont nem a tömeghez, hanem a térfogathoz viszonyítunk, a kőszénnél az érték 72 MJ/l, a földgáznál csak 10 MJ/l. Ha tehát az a szempont, hogy minél kisebb legyen az üzemanyag tömege, a földgáz a jobb választás, míg ha minél kisebb térfogatból szeretnénk minél nagyobb fűtőértéket kinyerni, akkor a szén a jó választás. Korábban már tanultunk egy olyan mennyiségről, ami segíthet ezt a vitát eldönteni, az anyagok mennyiségét mólban mérjük. Az égéshőt a legpontosabban kJ/mol-ban adhatjuk meg. A szén esetében ez 392 kJ/mol, a földgáznál 949 kJ/mol.
Néhány tüzelőanyag fűtőértéke kJ/kg-ban
| fa | 16000 |
| barnaszén | 25000 |
| feketeszén | 30000 |
| koksz | 32000 |
| fűtőolaj | 40000 |
| zsír és olaj | 35000 |
| szénhidrát | 18000 |
| kenyér | 10000 |
| sajt | 10000 |
| hús | 10-20ezer |
Az égéshő azt mutatja meg, hogy mekkora energia szabadul fel egy mol anyag elégetésekor.
Persze ha égésről van szó, akkor nem csak az számít, hogy mit égetünk, az sem mindegy, hogy mit próbálunk melegíteni ezzel. Ha alumíniumot és hőálló műanyagot melegítünk egyszerre, magunk is tapasztalhatjuk, hogy az alumínium hőmérséklete sokkal gyorsabban növekszik. Hogyan lehet ez, hiszen ugyanakkora energiát közöltünk velük? A különbség oka a két anyag eltérő szerkezetében van, míg a belső energiájuk ugyanúgy növekedett, a hőmérsékletük különböző sebességgel változott. Ezt a különbséget a moláris hőkapacitás mutatja meg nekünk (a hőkapacitás jele c). A moláris hőkapacitás azt mutatja meg, hogy mennyi energia kell ahhoz, hogy egy adott anyag egy móljának hőmérsékletét egy fokkal növeljük. A gyakorlatban a moláris hőkapacitás helyett gyakran inkább a fajlagos hőkapacitást használjuk, ami nem egy mól, hanem egy kg anyagra vonatkozik. A víz moláris hőkapacitása 75 J/mol*K, fajlagos hőkapacitása 4183 kJ/kg*K.
Térjünk még vissza az égéshőhöz! Mit is tanultunk az égésről, az nem más mint oxigénnel történő egyesülés. Valójában egy kémiai reakció játszódik le, melynek során az adott anyag reagál az oxigén molekulákkal. A szén égetésekor ennek végterméke szén-dioxid, a földgáz esetében szén-dioxid és víz. Az égéshő az az energia, ami felszabadul a reakció során. Nem csak az égéshez rendelhetünk ilyen energiamennyiséget, hanem bármilyen kémiai folyamathoz, reakcióhoz, ezt nevezik reakcióhőnek. Ezt a mennyiséget mindig a rendszer szempontjából nézzük, ha tehát az érték pozitív, az azt jelenti, hogy a rendszer energiája nő, tehát hőt vesz fel a környezetéből, míg a negatív érték esetében a rendszer energiája csökken, vagyis hőt ad le. Ha a reakcióhő pozitív a környezet hőmérséklete csökken, a reakció tehát hőcsökkentő azaz endoterm. A negatív reakcióhő esetében a leadott energia növeli a környezet energiáját, a folyamat tehát hőnövelő vagyis exoterm.
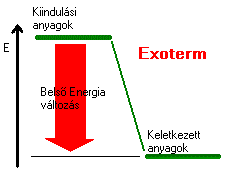 |
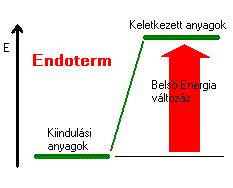 |
A reakcióhő függ a reagáló anyagok és a termékek halmazállapotától, így a termokémiai egyenletekben mindig feltüntetjük az anyagok vegyjelei mellett azok halmazállapotát is.
Az egyes vegyületeket előállíthatjuk elemeikből, az ilyen reakciók reakcióhőjét nevezzük az egyes vegyületek képződéshőjének. A képződéshő azt mutatja meg, milyen energiaváltozással jár egy anyag egy móljának előállítása elemeiből. Az elemek legstabilabb változatának képződéshőjét 0-nak vesszük és ehhez viszonyítva adjuk meg a vegyületek képződéshőjét.
|
 |
|
Ha egy reakció több módon is végbemehet, a részreakciókat kísérő energiaváltozások összege, azaz a reakcióhő független a részfolyamatok milyenségétől és sorrendjétől, csak a kiindulási és a végállapottól függ. Ezt az összefüggést Hess-tételnek nevezzük.
 Feladatok
Feladatok
11.1. Elégetünk 5 l földgázt hány kilogramm 25 Celsius fokos vizet tudunk
ezzel felforralni? (a földgáz égéshője 10 MJ/l, a víz fajlagos hőkapacitása
4183 KJ/kg*C)
11.2. A benzin égéshője 47,3 MJ/kg, a gázolajé 44,8 MJ/kg, melyiket lehet
hatékonyabban használni?
11.3. Mennyi energia szabadul fel 2,8 kg propán-bután gázkeverék elégetésekor,
hány kg fa elégetésének felel ez meg? (a propán-bután égéshője 50 MJ/kg,
a fa égéshője 15 MJ/kg)
11.4. Melyik gáz jobb a hőszigetelésre az ammónia vagy az oxigén? (ammónia
c=80 J/mol*K, oxigén c=29 J/mol*K)
![]() termokémia,
égéshő, reakcióhő, képződéshő, hőkapacitás, exoterm, endoterm, Hess-tétel
termokémia,
égéshő, reakcióhő, képződéshő, hőkapacitás, exoterm, endoterm, Hess-tétel