Kis emlékeztető korábbi tanulmányaidból:
Arisztotelész az anyag szerkezeti felépítését folyamatosnak képzelte el, vagyis olyannak, amely a teret összefüggően, hézagmentesen tölti ki. Démokrítosz (Kr.e. kb. 460-370) más véleményen volt. A mestere, Leukipposz által kigondolt atom fogalmát dolgozta ki. Démokrítosz szerint az anyagok apró, végtelen számú, szabad szemmel nem látható, tovább nem osztható részecskékből (atomokból) épülnek fel.
 "A világegyetem mozgó atomokból áll, számuk végtelen, mozgásuk
szükségszerű és örök. A természetben nincs se cél, se véletlen. Az atomok
alakja, mérete, súlya, mozgása, száma határozza meg a dolgokat. A lélek is
atomokból áll, éspedig legfinomabb, legmozgékonyabb atomokból: ha elhagyják
a testet beáll a halál."
"A világegyetem mozgó atomokból áll, számuk végtelen, mozgásuk
szükségszerű és örök. A természetben nincs se cél, se véletlen. Az atomok
alakja, mérete, súlya, mozgása, száma határozza meg a dolgokat. A lélek is
atomokból áll, éspedig legfinomabb, legmozgékonyabb atomokból: ha elhagyják
a testet beáll a halál."
Az ókori természetfilozófusok elméletei közel kétezer évig fennmaradtak. Az 1800-as évek elején Dalton elevenítette fel Démokrítosz gondolatait.
"Minden test a rendkívül parányi részek óriási számából áll, amelyeket a körülmények szerint erősebb, vagy gyengébb vonzóerő tart össze."
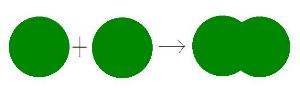
Az elemek azonos, a vegyületek különböző atomokból épülnek fel. Dalton az atomokat az anyag végső, tovább nem osztható alkotórészeinek tekinti. Az atomok meghatározott számban egymással kapcsolatot tudnak teremteni, így molekula jön létre. Dalton elmélete újabb lendületet adott az analitikusoknak. Atomokat, elem- és vegyületmolekulákat kezdtek el kutatni.
 |
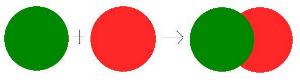 |
| Az elemmolekulák azonos | a vegyületmolekulák különböző atomok összekapcsolódásával jönnek létre. |
 John
Dalton: A kémia új rendszere
John
Dalton: A kémia új rendszere
John
Dalton
John
Dalton
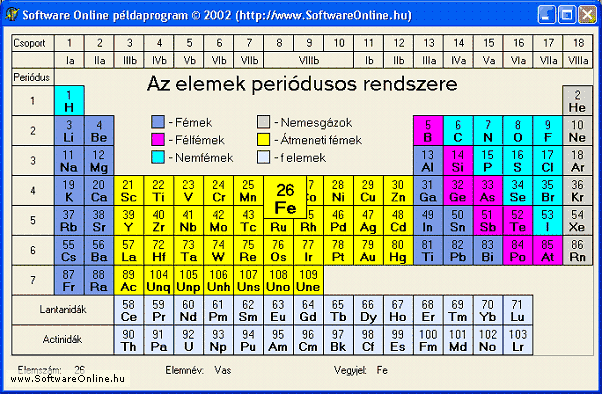
A XIX. század közepén már mintegy 60 elemet ismertek. Az elemek számának növekedésével egyre nagyobb problémát jelentett elnevezésük. A XVIII. század végétől bevezetik az egységes nevezéktant, megszületik a vegyjel.
Ma már tudjuk, hogy az anyagok valóban igen kisméretű atomokból épülnek fel, de azt is tudjuk, hogy Démokrítosz és Dalton elméletével ellentétben tovább oszthatók.
Elektronszerkezet
A korábbi tanulmányaidban már megismerkedtél az elemi részecskékkel. Tudod, hogy az atomokat protonok, neutronok és elektronok építik fel, sőt azt is, hogy az elektronok az elektronfelhőben keringenek. Tisztában vagy azzal, hogy az atomokban a protonok és elektronok száma megegyezik és azzal is, hogy az elektronok elektronhéjakra rendeződnek.
 2.1.
Fogalmazd meg, mit jelent: atommag, elektronfelhő, rendszám, tömegszám!
2.1.
Fogalmazd meg, mit jelent: atommag, elektronfelhő, rendszám, tömegszám!

 2.2.
Hány elektron lehet maximálisan az egyes (1., 2., 3.) főhéjakon?
2.2.
Hány elektron lehet maximálisan az egyes (1., 2., 3.) főhéjakon?
 |
A hidrogénnek egyetlen elektronja van. Elektronhéjait így jelöljük: 1s1 azaz az egyes főhéj, "s" mellékhéján egyetlen elektron van. A lítium három elektronjához már nem elegendő az 1. főhéj, így kiépül a 2. is. Jelölése: 1s22s1. Azaz a fentiekben leírtaknak megfelelően az első főhéjon kettő, a második főhéjon egy elektron kering. Az érthetőség kedvéért megadjuk még néhány atom elektronszerkezetét.
7N 1s22s22p5
13Al 1s22s22p63s23p1
20Ca 1s22s22p63s23p63d2
 2.3.
Most rajtad a sor! Add meg a következő atomok elektronszerkezetét: C, P,
Cl.
2.3.
Most rajtad a sor! Add meg a következő atomok elektronszerkezetét: C, P,
Cl.
2.4. Emlékezz csak vissza a periódusos rendszerről tanultakra! Mit mutat
meg a periódus szám? Mit mutat meg a főcsoportszám?
Az elektronszerkezet alapján pontosabban is meg
tudjuk magyarázni a molekulák szerkezetét, mint annak idején Dalton tette.
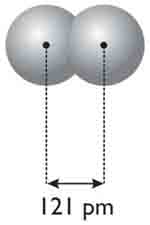
Tekintsük a hidrogén példáját!
Két hidrogén atom között oly módon létesül kapcsolat – kémiai szóval kötés,
hogy az elektronjaikat „közösen kezdik használni”. Ez nagyon képszerű megfogalmazás,
ezért hasznos, de nézzük, mi is történik igazából! Amikor két hidrogén atom
elég közel kerül egymáshoz, akkor a közelség miatt az atommagok protonjai
nem csak a saját, de a másik atom elektronját is vonzani fogják, így válnak
„közössé” az elektronok. A két elektron neve ekkor már kötőelektronpár, a
két vonzás által összekapcsolódott hidrogénatom neve pedig hidrogén-molekula.
A kémiai kötéseknek többféle típusával fogunk találkozni. Ezt a típust, amely
kötőelektronpár révén tartja össze a résztvevő atomokat – kovalens kötésnek
nevezzük.
Az oxigén kémiai tulajdonságai
 2.5.
Melyik főcsoportban található az oxigén? Hány legkülső elektronja van?
2.5.
Melyik főcsoportban található az oxigén? Hány legkülső elektronja van?
2.6. Rajzold le az oxigén kémiai jelölését, jelölve a legkülső elektronokat!
|
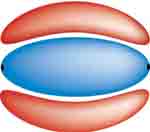
A képen az oxigénmolekula szerkezete látható. Ahogy korábbi tanulmányaidból tudhatot az oxigénmolekulában kétszeres kovalens kötés van. A két kötés közül az egyik, a szigma a két atommagot összekötő tengely mentén helyezkedik el. A másik, a pi-kötés a szigma-kötés alatt és felett helyezkedik el.
A két atommag közötti távolságot kötéstávolságnak nevezzük, mértékegysége a pikométer (pm). 1 pm=10-12 méter. |
 2.7.
Mivel magyarázható, hogy az oxigénatomok közötti kötési távolság nagyobb,
mint a hidrogénatomok közötti?
2.7.
Mivel magyarázható, hogy az oxigénatomok közötti kötési távolság nagyobb,
mint a hidrogénatomok közötti?
2.8 . Mi mondható el a szigma- és a pi-kötés erősségéről?
A kettős kovalens kötés viszonylag nagy stabilitást biztosít az oxigénmolekulának, ez azonban ellentmond a bevezetőkben írtaknak, ahol azt állítottuk, hogy az oxigén igen reakcióképes. Nos. Utóbbi állításunk igaz, csak annyi kitétel szükséges, hogy az oxigén megfelelő körülmények közt a legtöbb elemmel reagál. Szobahőmérsékleten kevésbé reakcióképes.
Az oxidációt a köznyelvben égésnek nevezzük, tehát az égés nem más, mint oxigénnel történő egyesülés. Azt már kevesebben tudják, hogy az égésnek több típusa van. Beszélhetünk gyors és lassú égésről, szénvegyületek égésekor tökéletes és tökéletlen égésről.
 |
 |
 |
 |
A gyors égést fény és hangjelenség kíséri. |
A lassú égést fény és hangjelenség nem kíséri. |
A tökéletes égéskor szén-dioxid keletkezik. |
A tökéletlen égéskor szén-monoxid keletkezik. |
 2.9.
Írd fel a tökéletes és a tökéletlen égés reakcióegyenletét!
2.9.
Írd fel a tökéletes és a tökéletlen égés reakcióegyenletét!
2.10. A képek segítségével nevezd meg mi mindenre használják az oxigént!
 |
 |
 |
|
. |
. |
. |
. |
A nitrogén kémiai tulajdonságai
 |
A nitrogénmolekula kémiai szerkezetéről már tanultál.
Háromszoros kovalens kötés tartja össze az atomokat, egy szigma- és
két pi-kötés. |
A nitrogénmolekula igen erős hármas kötése miatt kevésé reakcióképes, ún. inert gáz. Megfelelő körülmények közt reakcióba lép, reakciói közül a hidrogénnel és az oxigénnel történők jelentősek.
Az ammónia
A nitrogén és hidrogén egyesüléséből keletkező ammónia exoterm reakció eredménye, iparban magas hőmérsékleten (500 Celsius) és nyomáson (a légköri nyomás 300-szorosán) állítják elő. Az ammónia és más vegyületek elemeiből történő előállítását szintézisnek nevezzük. Az ammónia fontos vegyületek, többek közt műtrágyák, gyógyszerek, festékek, robbanószerek alapanyaga.
Az ammónia vizes oldata az ammónium-hidroxid, amely lúgos kémhatású vegyület.
 2.11.
Írd fel az ammónia és a víz reakciójának egyenletét!
2.11.
Írd fel az ammónia és a víz reakciójának egyenletét!
2.12. Korábbi tanulmányaid alapján idézd fel az exoterm és endoterm
fogalmat!
A nitrogén-oxidok
A nitrogén az oxigénnel csak speciális körülmények között egyesül. Természetben elsősorban villámláskor (3000 Celsius) megy végbe, erősen endoterm folyamat. A nitrogénnek számos oxidja ismeretes, a légkörben előforduló nitrogén-oxidok sárgásbarna, jellegzetes szagú elegyet alkotnak.
 2.13.
Az elnevezések alapján írd fel az alábbi nitrogénvegyületek összegképletét!
2.13.
Az elnevezések alapján írd fel az alábbi nitrogénvegyületek összegképletét!
A légkörban a *-gal jelölt nitrogén-oxidok fordulnak elő elsősorban
nitrogén-monoxid* |
. |
nitrogén-dioxid* |
. |
dinitrogén-oxid* |
. |
nitrogén-trioxid |
. |
dinitrogén-trioxid |
. |
dinitrogén-tetraoxid |
. |
A szén-dioxid kémiai tulajdonságai
A szintelen, szagtalan szén-dioxid elsősorban a tökéletes égés, valamint a légzés végtermékeként kerül a levegőbe. A négy vegyértékű szén és a hat vegyértékű oxigének között kétszeres kovalens kötés alakul ki, a szén-dioxid molekula téralkata lineráis (egyenes).
 2.14.
Rajzold le a szén-dioxid egyszerűsített szerkezeti képletét?
2.14.
Rajzold le a szén-dioxid egyszerűsített szerkezeti képletét?
 A
szén-dioxid kimutatása meszes vízzel
A
szén-dioxid kimutatása meszes vízzel
Kalcium-oxidot oldjunk fel vízben, majd szűrjük meg a keletkezett oldatot! Szívószál segítségével fújjunk levegőt a megszűrt meszes vízben. Azt tapasztaljuk, hogy a víz zavarossá válik.
 2.15.
Írd fel a meszes víz (mészoltás) előállításának reakcióegyenletét!
2.15.
Írd fel a meszes víz (mészoltás) előállításának reakcióegyenletét!
Az oltott mész (kalcium-hidroxid) szén-dioxiddal mészkővé (kalcium-karbonát) és vízzé alalkul.
 2.16.
Írd fel az oltott mész és a szén-dioxxid reakciójának egyenletét!
2.16.
Írd fel az oltott mész és a szén-dioxxid reakciójának egyenletét!
A szén-monoxid kémiai tulajdonságai
A négy vegyértékű szén és a hat vegyértékű oxigén között háromszoros kovalens kötés alakul ki, a kötés jellege a nitrogénmolekuláéhoz hasonló, egy lényeges különbség azonban van. A szén mellett nemkötő elektronpár helyezkedik el, így felmerül a kérdés, honnan származik a harmadik kötő elektronpár? A harmadik kötés mindkét elektronját az oxigén adja, ezt a kovalens kötés típust datív kötésnek nevezzük. A datív kötés elektronjait adó atomot donornak, az elektront fogadó atomot akceptornak nevezzük.
 2.17.
Írd fel az előző leckében tanult valamennyi molekula szerkezetét tanárod segítségével!
2.17.
Írd fel az előző leckében tanult valamennyi molekula szerkezetét tanárod segítségével!
![]() vegyület,
molekula, vegyjel, elemmolekula, vegyületmolekula, összegképlet, inert,
szintézis, donor, akceptor, datív kötés
vegyület,
molekula, vegyjel, elemmolekula, vegyületmolekula, összegképlet, inert,
szintézis, donor, akceptor, datív kötés