3. Halmazállapotok
Végezzünk el két kísérletet! Kémcsőben melegítsetek ként! Óraüveggel lefedett főzőpohárban melegítsetek jódot! Tapasztalataitokat foglaljátok jegyzőkönyvbe!
3.1. Milyen halmazállapotokat ismersz?
3.2. Hogyan nevezzük a halmazállapotok közötti átmeneteket, a különböző halmazállapot változásokat?
3.3. Írjátok fel a kén és a jód molekula szerkezetét?Vajon mi lehet az oka, hogy a hasonló szerkezetű – kovalens kötésekkel kapcsolódó kén és jód ilyen különbözően viselkedik melegítés hatására? És vajon miért nem olvad meg pl. a gyémánt hasonló körülmények között?
Hogy a fenti kérdéseket megválaszoljuk meg kell értenünk a szilárd anyagok szerkezetét!
Az feltehetően mindenki számára egyértelmű, hogy pl. a kőzetek, vagy a kristályok –, mint pl. a kén és a jód kristályai - szilárd halmazállapotú anyagok. Az azonban már keveseknek, hogy a szilárd anyagoknak két formája lehet. A kémiailag szilárd anyagok ún. kristályráccsal rendelkeznek (a szilárd anyagok többsége), a fizikailag szilárd anyagok kristályráccsal nem rendelkeznek, ún. amorf anyagok (üveg, amorf kén).
Ha egy nagyon nagy nagyítású mikroszkóppal megnéznénk ezeket láthatóvá válna, hogy természetesen ők is kémiai alkotókból, atomokból, (molekulákból) vagy ionokból épülnek fel. Ezek a kémiai részecskék az ún. rácspontokban helyezkednek el, ott helyhez kötöttek, de helyükön rezgőmozgást végeznek. A rácspontokban lévő részecskéket különböző kölcsönhatások "rögzítik" helyükön. A részecskék által kialakított legkisebb egységet, amelyből a kristályrács felépül elemi cellának nevezzük.
A kristályrács rácspontjaiban különböző részecskék lehetnek: atom, molekula, ion, fématomtörzs. Ennek megfelelően megkülönböztetünk atom-, molekula-, ion- és fémrácsot.Eddigi példáinkban kovalens kötésű molekulákkal foglalkoztunk, ezért lássuk először őket.
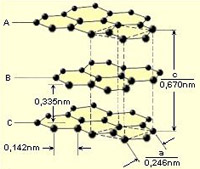
Molekularács
A molekularácsos anyagokat a kén molekula példáján szemléltetjük. A kénatomok 8 atomos molekulát képeznek, ezek (a nyolc atomból álló) molakulák lesznek a rácspontokban. A kénatomok között kovalens kötés van, a kénmolekulák között azonban csak gyengébb kötések. Melegítés hatására ezek a gyengébb kötések hamar felszakadnak és a molekula megolvad. Ezzel magyarázható a molekularácsos anyagoknak alacsony forrás- és olvadáspontja.
A kémiai kötések két nagy csoportba oszthatók. Vannak az elsőrendű és a másodrendű kötések. Ezekről jelenleg elég csak annyit kell tudnod, hogy az elsőrendű kémiai kötések sokkal nehezebben szakíthatók fel, mint a másodrendűek. Elsőrendű kötések közé tartozik a kovalens, az ionos és a fémes kötés, ezekről ebben a fejezetben tanulsz. A másodrendű kötések közül a hidrogénkötésről a víz epochában tanulsz majd.
Térjünk vissza a kísérletek után megfogalmazott kérdésekhez! Vajon mi lehet az oka, hogy a hasonló szerkezetű – kovalens kötésekkel kapcsolódó kén és jód ilyen különbözően viselkedik melegítés hatására?
A melegítés során akkor szűnik meg a szilárd halmazállapot, amikor a hőmozgás legyőzi a másodlagos kötések összetartó erejét, vagyis a molekulák elválnak egymástól. A jód molekulák sokkal kisebbek, így a köztük ható másodlagos kötőerő is gyengébb a kénmolekulák közötti erőnél. (Ez HASONLÍT -, de nem azonos - a gravitációs erő és a tömeg közötti arányossághoz.) A jódkristály így már kis hőközlés hatására is molekuláira szakad, míg a kén hosszabb melegítés után is csak folyékony halmazállapotig jut. További melegítés után a kén molekuláiban a kovalens kötések is felszakadnak, így szétesnek a molekulák is.
És vajon miért nem olvad meg pl. a gyémánt hasonló körülmények között? Erre a kérdésre akkor kaphatjuk meg a választ, ha a gyémánt szerkezetét jobban megértjük!
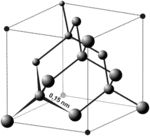
Atomrács
Az atomrács esetében a rácspontban lévő atomokat ún. kovalens kötés tartja össze. A kovalens kötés egy kémiai kötés, amely két atom elektronfelhőjének átfedésével jön létre.
Az atomrácsos anyagokra magas olvadás- és forráspont jellemző.
3.4. Töltsd ki a táblázatot!
szilárd
folyékony
gáz
Összetartó erő Részecskék elmozdulása Térkitöltés Alak Összenyomhatóság
kémiailag szilárd, fizikailag szilárd, rácspont, elemi cella, kovalens kötés, atomrács, ionrács, elsőrendű kötés, másodrendű kötés, molekularács