Víz a Földön
Mint már olvashattad a víz Földünk leggyakoribb vegyülete, amely mindhárom halmazállapotában előfordul.
Gáz halmazállapotban vízgőzként a légkörben, erről az Időjárás és éghajlat epochában tanulsz majd. A folyadék és szilárd halmazállapotban lévő víz két nagy csoportra osztható a kőzetburok kémiailag kötött vizére és a felszíni vízkészletre. Előbbi mennyisége nehezen határozható meg, becslések szerint a felszíni vízkészlet 15-50%-a lehet. A felszíni vízkészlet jól ismert, összesen kb. 1.384.000.000 km3 víztömeget jelent. A földi vízkészlet megoszlását a táblázat szemlélteti.
% megoszlás 97,4 óceánok és tengerek 2 magashegységi és sarkvidéki jég 0,58 felszín alatti szabad vizek 0,02 folyók, tavak, légkör, élőlények
Látható, hogy a földi vízkészlet döntő többsége a világtengerekben hullámzik. A Föld édesvízkészletének 90%-a hó- és jégtakarókban van. Ezek alapján elmondható, hogy Földünk felszínének kb. 71%-át óceánok és tengerek borítják.
 6.1.
A Földrajzi Atlasz segítségével próbáld meghatározni az alábbi objektumok
területét négyzetkilométerben!
6.1.
A Földrajzi Atlasz segítségével próbáld meghatározni az alábbi objektumok
területét négyzetkilométerben!
Csendes-óceán, Atlanti-óceán, Indiai-óceán, Földközi-tenger, Fekete-tenger,
Grönland, Arktisz, Antarktisz.
A Föld ivóvíz készlete és a víztakarékosság
 A
Földön a víz igen nagy mennyiségben van jelen. Ha egyenletesen volna elosztva,
a Föld felszínén mintegy 2700 méter vastag burkot lehetne belőle képezni.
Ebből úgy tűnhet, hogy a vízkészletek kimeríthetetlenek, holott valójában
a Föld ivóvíz- és iparivíz-készletei végesek. A Föld vízkészletének jelentős
része, mintegy 97%-a a tengerekben és óceánokban van jelen, amely magas sótartalma
miatt közvetlenül nem alkalmas sem ivóvíz-, sem iparivíz-felhasználásra, még
mezőgazdasági célokra sem. A fennmaradó 2-3% ugyan édesvíz, azonban nagy része
jég formájában található meg. Közvetlen ivóvíz-kitermelésre a Földön fellelhető
összes víznek alig 0,307%-a alkalmas, és ebben a mennyiségben már benne vannak
a kitermelhető felszíni vizek, a folyók, a tavak édesvizei, de még a felső
rétegvizek is.
A
Földön a víz igen nagy mennyiségben van jelen. Ha egyenletesen volna elosztva,
a Föld felszínén mintegy 2700 méter vastag burkot lehetne belőle képezni.
Ebből úgy tűnhet, hogy a vízkészletek kimeríthetetlenek, holott valójában
a Föld ivóvíz- és iparivíz-készletei végesek. A Föld vízkészletének jelentős
része, mintegy 97%-a a tengerekben és óceánokban van jelen, amely magas sótartalma
miatt közvetlenül nem alkalmas sem ivóvíz-, sem iparivíz-felhasználásra, még
mezőgazdasági célokra sem. A fennmaradó 2-3% ugyan édesvíz, azonban nagy része
jég formájában található meg. Közvetlen ivóvíz-kitermelésre a Földön fellelhető
összes víznek alig 0,307%-a alkalmas, és ebben a mennyiségben már benne vannak
a kitermelhető felszíni vizek, a folyók, a tavak édesvizei, de még a felső
rétegvizek is.
A lakosság életmódjának nagymértékű változása magával hozta a vízigény gyors ütemű növekedését is. Az embernek naponta átlagban 1,2-1,5 liter vízre van szüksége a szervezetében lezajló anyagcsere-folyamatokhoz. Természetesen ennél lényegesen nagyobb a napi vízfogyasztás, amely jelenleg egy városi embernél 150-300 liter vizet tesz ki. A víz a termelés szempontjából is alapvető jelentőségű, ahol alap- és segédanyagként, ill. szállítóközegként szerepelhet. A gazdaságon belül az ipar az egyik legnagyobb vízfelhasználó; az egyes iparágak közül a villamosenergia-iparnak van a legtöbb vízre szüksége, mindenekelőtt hűtési célokra.
 A
Föld vízkészlete
A
Föld vízkészlete
A hidroszféra
környezeti problémái
 Egyes
becslések szerint a fejlett ipari országok jelenleg 2-3-szor annyi vizet használnak,
mint amennyit a természetes vízkörforgás biztosít. Emiatt fokozódó mértékben
hasznosítják a rétegvíz-tartalékokat, ami a talajvíz szintjének nem kívánatos
csökkenésével jár, de egyre nagyobb mértékben kell a vízhiányt szennyezett
felszíni vizek költséges tisztításával is fedezni. Egyes területeken már jelenleg
is (pl. Kuvait), de a jövőben szélesebb körűen szükséges a tengervíz sómentesítésében
rejlő, ma még nagyon költséges lehetőségek kihasználása is.
Egyes
becslések szerint a fejlett ipari országok jelenleg 2-3-szor annyi vizet használnak,
mint amennyit a természetes vízkörforgás biztosít. Emiatt fokozódó mértékben
hasznosítják a rétegvíz-tartalékokat, ami a talajvíz szintjének nem kívánatos
csökkenésével jár, de egyre nagyobb mértékben kell a vízhiányt szennyezett
felszíni vizek költséges tisztításával is fedezni. Egyes területeken már jelenleg
is (pl. Kuvait), de a jövőben szélesebb körűen szükséges a tengervíz sómentesítésében
rejlő, ma még nagyon költséges lehetőségek kihasználása is.
Magyarország a vízben szegény országok közé tartozik, miután a természetes körforgásban kevesebb mint 1000 m3/fő/év csapadék jut az ország területére. Az ország felszíni vízkészletének több mint 90 %-a külföldről származik, vizeink alvízi jellegűek, így folyóink vízminőségét és mennyiségét sincs módunk szabályozni. Miközben a vízkészleteink egyelőre fedezni képes az ország vízigényét, problémát jelent, hogy míg a vízkészletek kb. 85 százaléka a Duna és 15 százaléka a Tisza vízrendszeréhez kötődik, addig a felhasználásban az igények 59 százaléka kötődik a Duna és 41 százaléka a Tisza vízrendszeréhez, így különösen aszályos időszakokban a Tisza térségében vízellátási gondok jelentkezhetnek.
 I.
Gondoljátok végig milyen víztakarékossági eljárásokat lehetne alkalmazni otthon,
illetve az iskolában!
I.
Gondoljátok végig milyen víztakarékossági eljárásokat lehetne alkalmazni otthon,
illetve az iskolában!
II. Készítsetek víztakarékossági transzparenseket!
III. Nézzetek után a világ vízszegény területeinek, országainak! Készítsetek
térképet!
A vízmolekula tulajdonságai
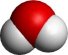
A természettudósok a vizet sokáig az egyszerű anyagok közé sorolták. Szerkezeti felépítését csak a XVIII. sz második felében sikerült tisztázni. Henry Cavendish angol kémikus megfigyelte, hogy hidrogén (ezt akkoriban gyúlékony levegőnek hívták) és levegő (akkoriban közönséges levegő) robbantásakor a hidrogén és a levegő 1/5-e egyesül (a levegő 21%-a oxigén) és páraként csapódik le. Tehát a pára hidrogénből és oxigénből áll. Cavendish a későbbiekben a térfogati viszonyokat is vizsgálta, s azt kapta, hogy két egység hidrogénből és egy egység oxigénből keletkezik a víz. Kísérleteit a francia származású Antoine Lavoisier (Lavoisier korábbi tanulmányodban) összegezte, illetve következtetett a végső megoldásra. Lavoisier 1783-ban bejelentette, hogy a víz két egység hidrogénből és egy egység oxigénből áll. Azaz összegképlete: H2O.
6.2. Mielőtt tovább lépnénk ismételd át a kémiai kötések kialakulását az alábbi kérdések segítségével!
Hány legkülső elektronja van a hidrogénnek?
Hány legkülső elektronja van az oxigénnek?
Elektronegativitásuk alapján milyen kémiai kötés alakul ki köztük?
Rajzold le a hidrogénatomot, jelölve a legkülső elektront!
Rajzold le az oxigénatomot, jelölve a legkülső elektronokat!
Rajzold le a vízmolekula szerkezeti képletét, jelölve a nemkötő elkektronpárokat!

hidrogénmolekula

oxigénmolekula
vízmolekula
A vízmolekulában a hidrogéneket és az oxigént kovalens kötés kapcsolja össze. A kovalens kötésnek azon fajtája, amelyet poláris kovalens kötésnek nevezünk. De mit is jelent ez?
Az atomok, atommagok különböző erősséggel képesek a közelükben levő elektronokat vonzani. Ez a képesség igen sok tényezőtől függ. Például az atom méretétől, a magban található protonok számától, stb. Hogy egyszerűen összehasonlíthassuk az atomokat ilyen szempontból, létrehoztak a kémikusok egy számot, amely az elektronvonzóképességet fejezi ki egy 0,7-től 4-ig terjedő skálán. Ez az elektronegativitás – jele: EN.
Az oxigén és a hidrogén eltérő elektronegativitású, ENO=3,5 , ENH=2,1 , így az oxigén a kötő elektronpárokat jobban maga felé vonzza. Az így kialakuló töltésszétválás okozza a kötés és egyben a molekula polaritását. A fenti képen a vízmolekulán belüli töltéseloszlás látható. Lila színnel a negatívabb, zöld színnel a kevésbé negatívabb területek.
A poláris kötésekben levő H atomok (amelyek részlegesen pozitív töltésűek) és egy szomszédos vízmolekula (negatív töltésű) nemkötő elektronpárja között vonzóerő alakul ki. Ez a molekulák közötti kölcsönhatás egy másodrendű kötés kialakulásához vezet, amit hidrogénkötésnek nevezünk. A hidrogénkötés kialakulásának feltétele, hogy a hidrogénhez nagy elektronegativitású atom (pl. N, O, F) kapcsolódjék. A vízmolekulák között kialakuló hidrogénhíd a legerősebb az intermolekuláris (molekulák közötti / másodrendű) kölcsönhatások közül. Előző tanulmányaidban már megismerkedtél a víz kiváló oldószer tulajdonágáról és az oldatokról is tanultál már. Poláris tulajdonsága miatt a víz a leggyakrabban használt oldószer.
Hidrogénkötés kialakulása - animáció
Ionok
A 8. főcsoport elemeit nemesgázoknak nevezzük, hisz ők a legstabilabbak. Ez azzal magyarázható, hogy legkülső héjaik telítettek. Minden atom arra törekszik, hogy legkülső elektronhéja telített legyen, másképp fogalmazva, hogy elérje a nemesgáz-szerkezetet. Ezt vagy úgy teheti meg, ha felvesz elektron(oka)t vagy, ha lead.
Vizsgáljuk meg az első főcsoport elemeit (Li, Na, K stb.). Legkülső elektronhéjukon 1 elektron van, konkrétan a Li elektronszerkezete 1s22s1. Azonban, ha lead egy elektront akkor eggyel több protonja lesz, így már nem tekinthető semlegesnek. Az eggyel több proton pontosan eggyel több pozitív töltést jelent majd, így jön létre a lítiumion Li+. Az első főcsoport valamennyi eleme úgy lesz stabil, hogy leadnak egy elektront, így egyszeresen pozitív ionná alakul. A gondolat a második és a harmadik főcsoportra is alkalmazható, ezek az elemek azonban kettő, illetve három elektront adnak le, azaz kétszeresen, illetve háromszorosan pozitív ionokká alakulnak. Pl. Mg2+, Al3+.
Mi a helyzet a magasabb főcsoportszámú elemekkel. A 8. főcsoport elemei ugyebár stabilak így nem adnak és nem is vesznek fel elektront. A hetedik főcsoport eleminek legkülső főhéján 7 elektron van.
Pl.
F 1s22s22p5
Cl 1s22s22p63s23p5
Nem lenne logikus, hogy 7 elektront adjanak le, az azonban már igen, hogy hét legkülső elektronjukat eggyel kiegészítve stabilizálódjanak. Ha azonban felvesznek egy elektront eggyel több negatív töltésük lesz, mint pozitív, így egyszeresen negatív ionná válnak. A negatív ionok -id végződést kapnak, ennek megfelelően fluoridion F-, kloridion Cl- stb.
Igazán nem nehéz a hatodik és ötödik főcsoport elemeinek ionná alakulását kitalálni. A hatodik főcsoport elemei kettő, az ötödiké három elektront vesznek fel, így kétszeresen, illetve háromszorosan negatív ionná válnak. Az ionok tehát nem mások, mint töltéssel rendelkező részecskék.
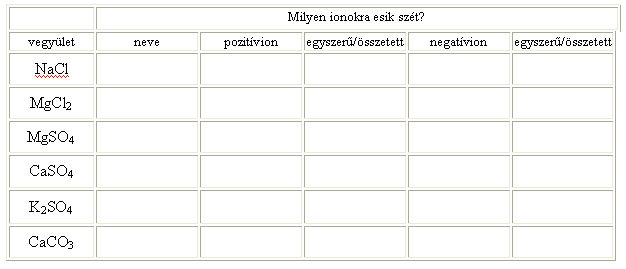
6.3. Írd fel az alábbi ionok jelölését: nátriumion, kalciumion, bórion, oxidion, bromidion.
6.4. Melyik atom ionját nevezzük szulfid-ionnak?
Léteznek olyan részecskék is, amelyekben az atomok kovalens kötéssel kapcsolódnak, mint a korábban megismert molekulákban, de töltést hordoznak. Ezeket nevezzük összetett ionoknak. Ilyen például a szulfát ion:
melynek összegképlete: SO42-
6.5. Töltsétek ki a következő táblázatot!
Ionrács
Ionrács esetén a rácspontokban egyszerű, vagy összetett pozitív, illetve negatív ionok helyezkednek el. A fejezet elején egyszerű ionokról tanultál. Az összetett ionok atomcsoportok elektron vesztésével, illetve bővülésével jönnek létre. Pl. NO3- - nitrátion, CO32+ - karbonátion.
Az ionokat ionos kötés tartja össze, amely az ellentétes töltésű ionok vonzásának köszönhető. Egyszerű ionokból épül fel a nátrium-klorid (Na+, Cl- konyhasó) ionrácsa, a mészkő (kalcium-karbonát Ca2+, CO32+) ionrácsában azonban már összetett ion is van. Az ionok az atomokhoz hasonlóan jelentős vonzást gyakorolnak elektronjaikra, így ezek helyhez kötöttek. A következmény, hogy nem vezetik az elektromos áramot. Mivel az ionok töltéssel rendelkező részecskék, olvadék formájában már vezetők lesznek. Az ionrácsos vegyületek kiválóan oldódnak vízben.
Összefoglalva: Ebben a leckében megértettük a víz különleges jelentőségét az életünkben. Majd megismertük pontos kémiai szerkezetét. Megismerkedtünk az ionokkal, melyek a vízben oldott anyagok döntő többségét képviselik.
poláris kovalens kötés, másodrendű kötés, hidrogénkötés, egyszerű ion, összetett ion, ionos kötés, ionrács