Tapasztalatból tudjuk, hogy a meleg teában hamarabb oldódik fel a cukor,
mint a hidegben. De vajon csak az oldódás sebessége, vagy az oldott anyag
mennyisége is növelhető a hőmérséklet emelésével?
Ha szobahőmérsékletű vízben kristálycukrot oldunk azt tapasztaljuk, hogy
egy idő elteltével nem oldódik fel több cukor, az oldandó anyag a pohár
alján marad. A cukor feletti oldat ekkor telített.
 7.7.
Mit tapasztalunk, ha elkezdjük melegíteni?
7.7.
Mit tapasztalunk, ha elkezdjük melegíteni?
Mint láttuk a hőmérséklet emelésével növelhetjük az oldandó anyag mennyiségét.
 7.8.
Mit tapasztalunk, ha a meleg, telített oldatot visszahűtjük szobahőmérsékletűre?
Magyarázd el, hogyan készülhet a kandiscukor!
7.8.
Mit tapasztalunk, ha a meleg, telített oldatot visszahűtjük szobahőmérsékletűre?
Magyarázd el, hogyan készülhet a kandiscukor!
7.9. Hogyan tudjuk még növelni az oldódás sebességét?
Az oldódást kísérő hőmérsékletváltozás
Vajon valamennyi oldandó anyag oldódását tudjuk növelni a hőmérséklet emelésével?
A kérdés megválaszolásához végezzük el az alábbi két kísérletet!
 II. Figyeljétek
meg a tanárod által bemutatott kísérletet! Kémcsőben lévő öt ujjnyi vízhez
tömény kénsavat csepegtet. Hogyan változik a kémcső hőmérséklete?
II. Figyeljétek
meg a tanárod által bemutatott kísérletet! Kémcsőben lévő öt ujjnyi vízhez
tömény kénsavat csepegtet. Hogyan változik a kémcső hőmérséklete?
III. Kémcsőben lévő öt ujjnyi vízhez tégy kiskanálnyi kálium-nitrátot!
Hogyan változik a kémcső hőmérséklete?
Mint láttuk vannak olyan esetek, amikor az oldódás hőmérséklet növekedéssel
jár és vannak olyan esetek, amikor hőmérséklet csökkenés kíséri. Előbbi
esetben a rendszer energiatartalma csökken, s azt környezetének adja át
(a környezet felmelegszik), ez az exoterm folyamat. A második esetben a
rendszer energiát vont el környezetétől, így energiája nőtt, a környezeté
csökkent (lehűlt), ez az endoterm folyamat.
 7.10.
Melyik reakciót lehet a hőmérséklet emelésével elősegíteni? Miért?
7.10.
Melyik reakciót lehet a hőmérséklet emelésével elősegíteni? Miért?
Vízben oldott gázok
A folyadékok nem csak szilárd anyagokat, gázokat is képesek oldani. Természetesen
ezt is sok tényező szabályozza, ezek közül talán legfontosabb a hőmérséklet.
A hőmérséklet emelésével a gázok oldhatósága csökken, így melegítéssel a
folyadékból eltávolíthatók. A víz sótartalmának növelésével a gázok oldhatósága
ugyancsak csökken. A tengervízben oldott gázok közül az oxigén és a szén-dioxid
a legfontosabb.
 7.11..
Korábbi tanulmányaid segítségével írd le az oxigénmolekula és a szén-dioxid
molekula jelölését!
7.11..
Korábbi tanulmányaid segítségével írd le az oxigénmolekula és a szén-dioxid
molekula jelölését!
Rajzold le szerkezeti képletüket! Milyen kémiai kötések tartják össze az
említett molekulákat?
7.12. Egy kísérlet során akváriumi halakat felforralt, majd lehűtött vízbe
helyeztünk. Miért pipálnak a víz felszínén?
Az élet, így vízi élet alapja is az oxigén. A víz oxigéntartalmát két fő
jelenség növeli, az egyik a vízfelszínen játszódik le, ahol a légkörrel
érintkező víz megköti az oxigént. Mint már utaltunk rá ez erősen hőmérsékletfüggő,
alacsonyabb hőmérsékleten nagyobb fokú a megkötődés. A másik jelenség a
vízi növények fotoszintézisével magyarázható.
 7.13.
Mit jelent a fotoszintézis fogalma? Írd le a fotoszintézis egyszerűsített
reakcióegyenletét!
7.13.
Mit jelent a fotoszintézis fogalma? Írd le a fotoszintézis egyszerűsített
reakcióegyenletét!
A víz felszín közeli részeiről a függőleges áramlások keverő hatása juttatja
a mélyebb rétegekbe a légzéshez nélkülözhetetlen gázt. Ahol nagy folyók
kis sűrűségű édesvíztömegeket juttatnak a világtengerekbe, megszűnhet ez
a függőleges vízcsere, mert az édesvíz felrétegződik a sűrűbb tengervíz
tetejére, így akadályozza a feláramlást, és ezzel az átszellőzést. Ebben
az esetben a mélyvizek oxigénkészlete előbb-utóbb elhasználódik, ráadásul
szén-dioxid és kén-hidrogén gázok gyűlnek fel benne, a tengeri élet pedig
lehetetlenné válik. Jó példa erre a Fekete-tenger esete, amelyben 200 méternél
mélyebben semmiféle élet nem létezik.
A tengervízben lévő szén-dioxid szénsavként van jelen, azaz kémiai reakció
során oldódik a vízben, az alábbiak szerint:
H2O + CO2 = H2CO3
A szén-dioxid egyrészt a légkörből, másrészt a tengeri
élőlények anyagcseréjéből (légzés) és lebomlásából származik. A víz szén-dioxid
elnyelő képessége nagy mértékben függ a nyomástól, minél nagyobb, annál
több szén-dioxidot tud elnyelni, mélyebb tengerszinteken ezért sokszorosára
nő. A felszíni vizekben a hőmérséklet a fő szabályozó, a hideg víz többet
tud elnyelni.
Az édesvizek sótartalma
Az édesvizekben is találhatók különböző sóvegyületek, amelyek
az ún. vízkeménységet okozzák. A víz természetes körforgása
során a lágy esővíz ásványi anyagokat old ki a talajból, főleg meszet (CaCO3),
gipszet (CaSO4) és magnézium-szulfátot (MgSO4). Az
adott talaj összetételétől függően több vagy kevesebb ilyen oldott ásványi
anyag van a vízben. Nagy mennyiségű ásványi anyag nagy vízkeménységet jelent.
Így például az ásványvizek különösen keménynek számítanak. Általánosan a
közepesen kemény vizet tekintjük különösen jó ivóvíznek.
A vízben oldott kálcium-hidrogén-karbonát - Ca(HCO3)
- és magnézium-hidrogén-karbonát - Mg(HCO3) - felelős az ún.
változó keménységért, amely forralással megszüntethető,
a többi kálcium- és magnéziumvegyületből származik az állandó keménység,
amely forralással nem távolítható el. Ipari, mezőgazdasági és háztartási
célból is fontos a vizek keménysége. A keményvízből kiváló sók eltömíthetik
a vízvezetékeket, ezzel akár robbanást is előidézhetnek (pl.: kazán). A
keménységet ún. keménységi fokban adják meg.
 Nézd
meg hazánk vízkeménységi
térképét!
Nézd
meg hazánk vízkeménységi
térképét!
Budapest kerületeinek vízkeménysége itt.
A vízkeménység és az egészség itt.
 |
A vízkeménységet
gyakran adják meg német keménységi fokban (od vagy odH).
A mosóporok csomagolásán Ezeket az értékeket általában négy fokozatra
osztják:
1. 0 – 7od lágy
2. 7 – 14od középkemény
3. 14 - 21od kemény
4. 21od fölött nagyon kemény
Ha a keménységi mutató alacsony, akkor a víz lágy és kevesebb szappanra
vagy mosószerre van szükség. A mosóporok csomagolásán általában feltüntetik
a vízkeménység függvényében szükséges mosópor mennyiségét. Ha a víz
lágy, akár 20% mosópor is megtakarítható, ami egyaránt kíméli a pénztárcát
és a környezetet is. Még környezetbarátabb megoldás a moduláris rendszerű
gépek használata. Ebben az esetben a mosópor, a fehérítő és a vízlágyító
külön-külön, a szükséges mennyiségben adagolhatóak. Ha a víz nagyon
lágy, egyáltalán nem szükséges vízlágyítót használni. A kemény vizet
azonban szükséges lágyítani, mert több mosás után a ruhák megkeményednek.
A mosóvízhez adott ecet feloldja a vízkövet és újra lággyá teszi a
ruhákat. A fütőszálakra lerakódott vízkő növeli az energiafogyasztást.
|
Természetes vizek nitráttartalma
Kis mennyiségű nitrát (-NO3-
) szinte minden természetes vízben kimutatható. A felszíni vizek
nitrát-tartalma 0-8 mg/liter között van, a szennyezett vizek 50-150
mg/litert, vagy ennél is többet tartalmazhatnak. Hogyan kerül nitrát a vízbe? Az
intenzív mezőgazdaságban nagy mennyiségben használt műtrágyákból, sérült
csővezetékeken keresztül, sérült, vagy a magán-kutakhoz túl közel telepített
ülepítőkből. Az EU területén az ivóvíz nitrát-tartalmának küszöbértéke 50
mg/liter. Miért veszélyes a magas nitráttartalom? A szervezetben a nitrát
nitritté (-NO2- )alakul. A csecsemők és kisgyermekek
számára a nitrit közvetlenül is veszélyes, még a hivatalos határérték
alatti dózisban is. A vérben az oxigén szállításáért felelős molekulát
károsítja, így elégtelen oxigénellátást okoz. A mérgezés tünetei
a kék ajkak, kezek és lábak, fejfájás, légzési nehézségek, legrosszabb
esetben fulladás.

I. Töltsetek meg egy befőttes
üveget csapvízzel, majd mérjétek meg oxigéntartalmát. Helyezzetek bel egy
akváriumi növényt, fölé egy fényforrást és 24 órán keresztül hagyjátok bekapcsolva
a lámpát. Ezt követően mérjétek meg ismét az oxigéntartalmat. Mit tapasztaltok?
II. Mérjétek meg
egy kristályosítócsésze tömegét! Töltsetek bele 10 cm3 tengervizet,
majd vízfördőn (vagy radiátoron néhány napig) pároljátok. Amikor az összes
víz elpárolgott mérjétek meg ismét a csésze tömegét. Számítsátok ki mennyi
só vált ki! Hány tömegszázalékos lehetett a vizsgált oldat? A sóoldat sűrűségét
1,1 g/cm3-nek vegyétek.
III. Nézzetek után milyen
elemek, vegyületek találhatók az ivóvízben! Milyen élettani hatásuk van,
mennyi a megengedett értékük? Segítségnek egy  link.
link.
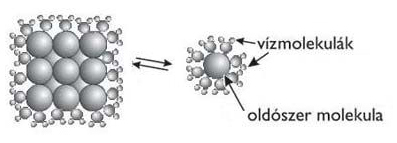
 oldat,
oldószer, oldott anyag, hidrátburok, diffúzió, vízkeménység, változó keménység,
állandó keménység, keménységi fok
oldat,
oldószer, oldott anyag, hidrátburok, diffúzió, vízkeménység, változó keménység,
állandó keménység, keménységi fok
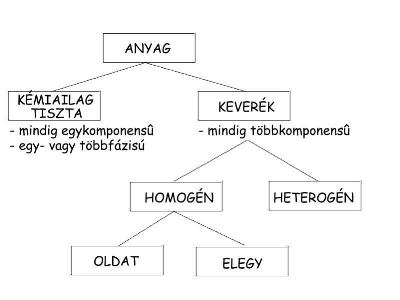
 7.1.
Pohárnyi vízben oldj fel kanálnyi konyhasót! A keletkező anyag kémiailag
tiszta vagy keverék?
7.1.
Pohárnyi vízben oldj fel kanálnyi konyhasót! A keletkező anyag kémiailag
tiszta vagy keverék? 7
.3. Mit jelent a fázis kifejezés?
7
.3. Mit jelent a fázis kifejezés? 7
.4. Mit jelent a komponens kifejezés?
7
.4. Mit jelent a komponens kifejezés?