2. Oxigéntartalmú szénvegületek
ISM. Ismételd át a kovalens kötés típusait, a poláris, apoláris kovalens kötés és az elektronegativitás fogalmát! Pl.: itt.
Az oxigéntartalmú szénvegyületek molekuláiban a szén- és a hidrogénatomok mellett oxigénatom(ok) is van(nak).
2.1. Hidroxivegyületek
A hidroxivegyületekben a szénatom(ok)hoz egy ún. hidroxilcsoport kapcsolódik. Abban az esetben, ha a hidroxilcsoport telített szénatomhoz kapcsolódik alkoholról, ha aromás gyűrűhöz fenolról beszélünk.
![]() A
hidroxilcsoport egyszerűsített és nemkötő elektronpárokat jelölő ábrázolása.
A
hidroxilcsoport egyszerűsített és nemkötő elektronpárokat jelölő ábrázolása.
2.1.1. Alkoholok
Elnevezés: a megfelelő szénhidrogén nevéhez kapcsolt -ol végződéssel képezzük. A végződés előtt számmal jelezzük, hogy hányadik szénatomhoz kapcsolódik a hidroxilcsoport. Pl.:
CH3-CH2-CH2-OH propán-1-ol
Az alkánokból származtatott alkoholok szabályos neve alkanol.
Csoportosítás: az alkoholokat csoportosíthatjuk rendűség szerint, amely azon alapszik, hogy a hidroxilcsoporthoz kapcsolódó szénatom, hány másik szénatommal kapcsolódik. Ha eggyel elsőrendű, ha kettővel másodrendű, ha hárommal harmadrendő az adott alkohol. A másik csoportosítási lehetőség az értékűség, amely a molekulában található hidroxilcsoportok számának felel meg. Egy hidroxilcsoport esetén egyértékű az alkohol, kettő esetén kétértékű és így tovább.
Szerkezet:* a hidroxilcsoport hidrogénje és oxigénje között poláris kovalens kötés alakul ki mivel, az oxigén elektronegativitása nagyobb, mint a hidrogéné. Ebből következően az oxigén maga felé vonzza a kötő elektronpárt. Ugyanezen logika alapján a szén - oxigén közötti kötés is poláris, itt is az oxigénatom felé torzul az elektronfelhő, azonban minél hosszabb a szénatomlánc annál inkább csökken a kötés polaritása.
Előfordulás, ismertebb alkoholok:
2.1.1.1. Metanol (metil-alkohol, faszesz) CH3-OH
A legegyszerűbb alkohol, amely kitűnő oldószer, sok egyszerű
szénvegyület előállításának alapanyaga, nagyon súlyos méreg! Már viszonylag
kis mennyisége is súlyos tüneteket okoz. ![]()
Kémiai tulajdonságai az etanolhoz hasonlóak. A metanolt napjainkban elsősorban szintézisgázból (szén-monoxid, hidrogéngáz) állítják elő, az előállítás magas hőmérsékleten és nyomáson katalizátor jelenlétében történik.
CO + H2 = CH3OH
 1.
Nézz utána milyen tünetei vannak a metil-alkohol mérgezésnek!
1.
Nézz utána milyen tünetei vannak a metil-alkohol mérgezésnek!
2.1.1.2. Etanol (etil-alkohol) CH3-CH2-OH
Ez az a vegyület, amelyet a mindennapi életben alkoholnak
nevezünk, s amelyet szeszes italok alapjában ősidők óta ismerünk. Legnagyobb
mennyiségben cukortartalmú gyümölcslevek, továbbá burgonya, kukorica, gabona
erjesztésével állítják elő. A szeszes erjedés élesztőgombák hatására játszódik
le. Erjesztéssel csak bor töménységű, vagyis legfeljebb 15-18%-os vizes alkohololdatot
lehet előállítani, nagyobb töménységű alkohololdatban az élesztő elpusztul.
A töményebb alkoholos italokat lepárlással készítik. ![]()
Tulajdonságai:
- színtelen, víznél kisebb sűrűségű, kellemes illatú folyadék;
- vízzel és apoláris oldószerekkel kitűnően elegyedik;
- kitűnő oldószer;
- az alkoholmolekulák között hidrogénkötések alakulnak ki;
- meggyújtva kékes lánggal ég
C2H5-OH + 3O2 = 2CO2
+ 3H2O
A szeszes italok gyártása mellett felhasználják fertőtlenítésre (70%) és oldószerként.
Az alkohol egyrésze már a szájüregben
felszívódik a keringési rendszerben, többsége azonban csak a vékonybél
mikrobolyhainál. A vérútján eljutva a központi idegrendszerbe (agy)
csökkenti a feszültséget, szédülést, mámort okoz. Eleinte "feldobottak"
vagyunk, néhány óra múlva (vagy akár előbb) teljesítőképességünk jelentősen
csökken. A sejtekbe jutott alkohol anyagcserezavarokat okoz (kicsapja
a fehérjéket), az alkohol acetaldehiddé alakul, amely émelygést, hányást,
fejfájást, egyensúly- és látászavart, ájulást, eszméletvesztést okozhat.
|
A kultúrált ember alkoholfogyasztására a mértéktartás jellemző. A rendszeres és mértéktelen italozás egyaránt károsítja a testet, a lelket és a szellemet!
 2.
Nézzetek utána, hogyan készül a bor! Nevezzétek meg a bor- és borospohár típusokat!
Mutassátok be hazánk legjelentősebb borvidékeit!
2.
Nézzetek utána, hogyan készül a bor! Nevezzétek meg a bor- és borospohár típusokat!
Mutassátok be hazánk legjelentősebb borvidékeit!
3. Nézzetek utána, hogyan készül a sör! Ismertessétek hazánk legnagyobb sörgyárait!
4. A táblázat kitöltésével nézzetek utána, hogy készülnek az egyes röviditalok!
Rövidital neve |
Alapanyaga |
Egyéb (származási hely, típusai stb.) |
| rum | ||
| vodka | ||
| whisky, whiskey | ||
| gyümölcspálinkák | ||
5. Milyen hatásai vannak a rendszeres alkoholfogyasztásnak?
2.1.1.3. Glikol (etán-1,2-diol)
Kétértékű alkohol, amely színtelen, sűrűn folyó (viszkózus), édes ízű, mérgező folyadék. Legelterjedtebb felhasználása gépkocsik fagyállójaként.
2.1.1.4. Glicerin (propán-1,2,3-triol)
Háromértékű alkohol, amely színtelen, szagtalan, édes ízű, viszkózus, erősen nedvszívó (higroszkópos), nem mérgező folyadék. Élőlények alkotórészeként nagyon elterjedt a természetben.
 5.
Nézzetek utána a glicerin-trinitrát (helytelenül nitroglicerin) felfedezésének,
gyógyászati alkalmazásának!
5.
Nézzetek utána a glicerin-trinitrát (helytelenül nitroglicerin) felfedezésének,
gyógyászati alkalmazásának!
6. Teszteljétek az alábbi alkohol-kalkulátorokat!
 Alkoholszint
kalkulátor
Alkoholszint
kalkulátor
Alkohol
teszt
Alkohol-függőség
kalkulátor
2.1.2. Fenolok
![]() Legegyszerűbb
képviselőjük a fenol, amely színtelen, jellemző szagú, mérgező szilárd anyag.
Utóbbi tulajdonsága miatt használták vasúti talpfák tartósítására.Vízben csak
korlátozottan oldódik, apoláris oldószerekben viszont apoláris gyűrűje miatt
jól.
Legegyszerűbb
képviselőjük a fenol, amely színtelen, jellemző szagú, mérgező szilárd anyag.
Utóbbi tulajdonsága miatt használták vasúti talpfák tartósítására.Vízben csak
korlátozottan oldódik, apoláris oldószerekben viszont apoláris gyűrűje miatt
jól. ![]()
A bőrfelületre jutó fenol súlyos marási sebet okoz, és könnyen felszívódik. Szervezetbe jutása vagy gőzeinek belégzése légzésbénulást, kábultságot, vesebántalmakat, szívbénulást okoz.
2.2. Éterek
Az éterek olyan oxigéntartalmú szerves vegyületek, amelyek molekuláiban az oxigénatomhoz két szénatom kapcsolódik. A kisebb szénatomszámú éterek folyadékok, míg a nagyobbak kristályosak.
Elnevezés: az oxigénatomhoz kapcsolódó szénhidrogéncsoportok neve abc-sorrendben, mögé illesztve az éter szócskát. Pl.:
| CH3-O-CH3 dimetil-éter | 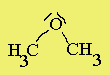 |
Szerkezet:* a szén- és az oxigénatom közötti kötés poláris, emiatt az egész molekula kis mértékben poláris (dipólusos).
2.2.1. Dietil-éter
Színtelen, jellemző édeskés szagú (bódító), gyúlékony folyadék, amelynek forráspontja 35 Celsius. Vízben kismértékben, alkoholban korlátlanul oldódik. Gőzei levegővel robbanóelegyet képeznek. Toxikus hatása miatt altatásra ma már nem használják, elsősorban oldószerként alkalmazzák. Égésének reakcióegyenlete:
C2H5-O-C2H5 + 6O2 = 4CO2 + 5H2O
A dietil-éter gőzei levegővel robbanóelegyet
képeznek. 
2.3. Oxovegyületek
Az oxovegyületek olyan szerves vegyületek, melyekben ún. oxocsoport található. Abban az esetben, ha az oxocsoport láncvégi szénatomhoz kapcsolódik aldehidről, ha láncközti vagy gyűrűs szénatomhoz ketonról beszélünk.
2.3.1. Aldehidek
Elnevezés: alapszénhidrogén nevéhez
-al szócska. Pl.: metanal (CH2O). Az alkánokból levezethető
aldehidek típusneve: alkanal. Az aldehidek lehetséges funkciós csoportjait
az alábbi ábrák szemléltetik. ![]()
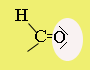 |
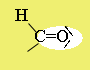 |
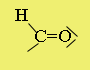 |
oxocsoport |
karbonilcsoport |
formilcsoport |
Szerkezet:* a szén-oxigén (karbonilcsoport) közötti kötés erősen poláris, mert a nagy elektronegativitású oxigénatom a pi-kötés elektronpárját maga felé vonzza.
2.3.1.1. Formaldehid (metanal)
A legegyszerűbb aldehid. Színtelen, szúrós szagú, mérgező gáz. Vízben jól oldódik, vizes oldata a formalin. Tartósítás és fertőtlenítés mellett a műanyaggyártás fontos alapanyaga.
A formaldehid mérgező, a fehérjéket kicsapja, sejtméreg!
2.3.1.2. Acetaldehid (etanal)
Színtelen, kellemetlen szagú, alacsony forráspontú (20C) folyadék. Többi tulajdonságaiban nagyon hasonlít a formaldehidhez.
2.3.1. Ketonok
Olyan oxovegyületek, amelyek molekuláiban az oxocsoport láncközi
vagy gyűrűs szénatomhoz kapcsolódik. ![]()
Elnevezés: alapszénhidrogén nevéhez -on szócska. Pl.: propanon (CH3-CO-CH3). Az oxocsoport helyzetét a végződés elé tett számmal adjuk meg (propán-2-on).
Szerkezet:* A karbonilcsoport erősen
poláris, mivel az oxigénatom nagy elektronegativitású a pi-kötés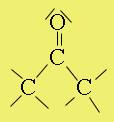 gyengén kötött elektronpárját nagy mértékben magához vonzza. Emiatt a ketonok
között erős másodrendű kötések, ún. dipólus-dipólus kölcsönhatás lép fel.
gyengén kötött elektronpárját nagy mértékben magához vonzza. Emiatt a ketonok
között erős másodrendű kötések, ún. dipólus-dipólus kölcsönhatás lép fel.
2.3.1.1. Aceton (propán-2-on)
A legegyszerűbb és legismertebb keton. Színtelen, kellemes szagú, tűzveszélyes folyadék. Vízzel és szerves oldószerekkel is elegyedik. Elsősorban oldószerként használják.
2.4. Karbonsavak
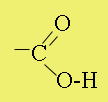 A
karbonsavak jellemző funkciós csoportja a karboxilcsoport, amely két egyszerű
funkciós csoportból, egy hidroxi- és egy oxocsoportból épül fel. Az azonos
szénatomhoz kapcsolódó funkciós csoportok nem függetlenek egymástól, emiatt
új, az önálló funkcióscsoportokra eredetileg nem jellemző tulajdonságok jelennek
meg. Az ilyen molekularészeket összetett funkciós csoportnak nevezzük.
A
karbonsavak jellemző funkciós csoportja a karboxilcsoport, amely két egyszerű
funkciós csoportból, egy hidroxi- és egy oxocsoportból épül fel. Az azonos
szénatomhoz kapcsolódó funkciós csoportok nem függetlenek egymástól, emiatt
új, az önálló funkcióscsoportokra eredetileg nem jellemző tulajdonságok jelennek
meg. Az ilyen molekularészeket összetett funkciós csoportnak nevezzük. ![]()
Elnevezés: alapszénhidrogén neve után -sav szócska. Pl.: metánsav (HCOOH). Az alkánokból levezethető karbonsavak típusneve: alkánsav vagy zsírsav.
Szerkezet:* Az oxocsoport nagy elektronegativitású oxigénje maga felé vonzza a hidroxicsoportot alkotó oxigén és hidrogén közti elektront, a hidroxicsoport polárisabbá válik, mint az alkoholokban, a hidrogén könnyebben leszakítható, így vizes oldatuk savként viselkedik. A protonvesztéssel keletkező ion neve: karboxilátion.
Léteznek többértékű karbonsavak is.
2.4.1. Hangyasav (metánsav)
A legegyszerűbb karbonsav. Szúrós szagú, színtelen folyadék. Vízzel, etil-alkohollal minden arányban elegyedik. Bőrre kerülve erősen maró hatású. Hangyasavat tartalmaz többek közt bizonyos hangyák, méhek, szúnyogok és csalánok csípése.
2.4.2. Ecetsav (etánsav)
A legismertebb karbonsav, melyet a hétköznapi életben ecetként ismerünk. Etil-alkoholból a levegő oxigénje és ecetsav-baktériumok hatására ecetsav képződik. Szúrós szagú, színtelen folyadék, amely vízzel minden arányban elegyedik. Vízmentes állapotban 17oC alatt a jéghez hasonlóan megszilárdul, ezért a tömény ecetsavat jégecetnek nevezik.
Ecetes ételeket fémedényben nem szabad tárolni, mert az ecetsav a fémeket megtámadja és mérgező fémvegyületekké alakítja! Pl.: réz.
2.4.3. További fontos karbonsavak
Az alábbi táblázat az élőlényekben betöltött szerepük miatt fontos karbonsavak nevét és képletét tartalmazza.
palmitinsav |
sztearinsav |
olajsav |
C15H31-COOH |
C17H35-COOH |
C17H33-COOH |
2.5. Az oxigéntartalmú szénvegyületek fizikai és kémiai tulajdonságai*
Az alábbi táblázat egyes szénvegyületek forráspontját szemlélteti. Összehasonlításkor a közel azonos molekulatömegű vegyületek értékeit használjuk.
moláris tömeg (g) |
Fp (oC) |
|
| etán | 30 |
-89 |
| metil-alkohol | 32 |
65 |
| formaldehid | 30 |
-21 |
| propán | 44 |
-42,1 |
| etil-alkohol | 46 |
78,4 |
| dimetil-éter | 46 |
-24 |
| acetaldehid | 44 |
21 |
| hangyasav | 46 |
101 |
| bután | 58 |
0 |
| propil-alkohol | 60 |
97 |
| propanal | 56 |
49 |
| propanon | 58 |
56 |
| ecetsav | 60 |
118 |
| pentán | 72 |
36 |
| butil-alkohol | 74 |
118 |
| dietil-éter | 74 |
35 |
| fenol | 94 |
181,8 |
| toluol | 92 |
110,6 |
Forrás- és olvadáspont
- az etil-alkoholban (alkoholokban) a vízhez hasonló hidrogénkötések
alakulnak ki, ezért magasabb a forráspontja a propánénál;
- a fenolban szintén hidrogénkötések alakulnak ki ezzel magyarázható, hogy
jóval magassabb a forrás- és olvadáspontja, mint a toluolé;
- az éterek nem alakítanak ki hidrogénkötést ezért alacsony a forráspontjuk,
gyenge diszperziós és dipólus-dipólus kölcsönhatások azonban kialakulnak;
- az aldehidek forráspontja a megfelelő alkoholhoz viszonyítva alacsonyabb,
mert hidrogénkötés nem, csak dipólus-dipólus kölcsönhatás alakul ki molekuláik
között;
- a ketonok forrás- és olvadáspontja közel esik az azonos szénatomszámú aldehidek
forrás- és olvadáspontjához;
- a karbonsavak forrás- és olvadáspontja a molekulák között kialakuló hidrogénkötések
miatt viszonylag magas;
Kémhatás
- az alkoholok vizes oldata semleges kémhatású, de egyes
reakciókban gyenge savként viselkednek;
- a fenol vizes oldata gyengén savas kémhatású, amely az alábbi reakcióegyenlet
alapján értelmezhető:
| + H2O | = | +H3O+ |
A keletkezőion neve fenolátion (és természetesen oxóniumion).
- az éterek bázisként viselkednek, mivel az oxigénatom nemkötő
elektronjai erős savaktól protont vehetnek el;
- a karbonsavak savként viselkednek, a legerősebb szerves savak;
Előállítás
- az alkoholok előállításának több lehetősége van itt csupán
néhányat említünk.
1. Aldehidből redukcióval R-CH=O = R-CH2-OH
2. Karbonsavból vízelvonással R-COOH = R-CH2-OH + H2O
- az éterek az alkoholok fontos származékai;
![]()
- az aldehidek (telített, nyílt láncú) a megfelelő szénatomszámú elsőrendű alkoholok oxidációjával (dehidrogénezésével) állíthatók elő. A formaldehidet metanolból gyártják magas nyomáson és hőmérsékleten, katalizátor jelenlétében;
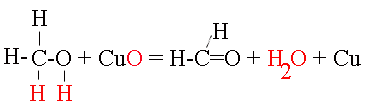
- a ketonokat az aldehidekhez hasonlóan oxidációval állítják elő, a kiindulási vegyület szekunder alkohol;
 6.
A dietil-étert etil-alkoholból állítják elő 130
oC-on, tömény kénsav segítségével. Írd fel a reakcióegyenletet!
6.
A dietil-étert etil-alkoholból állítják elő 130
oC-on, tömény kénsav segítségével. Írd fel a reakcióegyenletet!
7. A táblázat alapján válaszoljatok az alábbi kérdésekre!
Hogyan változik az egyértékű alkoholok, aldehidek, ketonok,
karbonsavak forráspontja a szénatomszám növekedésével?
Állítsd sorrendbe az oxigéntartalmú szénvegyületek egyes tíípusait növekvő
forráspont alalpján!
 hidroxivegyület,
hidroxilcsoport, alkohol, fenol, alkanol, rendűség, értékűség, szintézis gáz,
hidrogénkötés, apoláris oldószer, viszkózus, higroszkópos, éter, oxovegyület,
aldehid, keton, oxocsoport, karbonilcsoport, formilkötés, másodrendű kötés,
dipólus-dipólus kölcsönhatás, karboxilcsoport
hidroxivegyület,
hidroxilcsoport, alkohol, fenol, alkanol, rendűség, értékűség, szintézis gáz,
hidrogénkötés, apoláris oldószer, viszkózus, higroszkópos, éter, oxovegyület,
aldehid, keton, oxocsoport, karbonilcsoport, formilkötés, másodrendű kötés,
dipólus-dipólus kölcsönhatás, karboxilcsoport