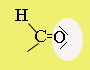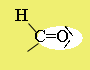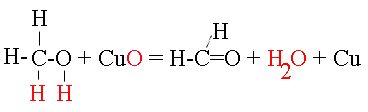Oxigéntartalmú szénvegyületek
Mint, ahogy említettük az oxigéntartalmú szénvegyületeknek négy csoportjával ismerkedünk meg:
1. hidroxivegyületek
2. oxovegyületek
3. éterek
4. karbonsavak1. Hidroxivegyületek
A hidroxivegyületek csoportosításáról már volt szó itt, és egyik legismertebb csoportjuk, az alkoholkról is beszéltünk már. Másik csoportjuk rövid ismertetését az alábbiakban olvashatod.
1.2. Fenolok*
Legegyszerűbb képviselőjük a fenol, amely színtelen, jellemző szagú, mérgező szilárd anyag. Utóbbi tulajdonsága miatt használták vasúti talpfák tartósítására. Vízben csak korlátozottan oldódik, apoláris oldószerekben viszont apoláris gyűrűje miatt jól.
A bőrfelületre jutó fenol súlyos marási sebet okoz, és könnyen felszívódik. Szervezetbe jutása vagy gőzeinek belégzése légzésbénulást, kábultságot, vesebántalmakat, szívbénulást okoz.
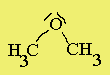
2. Éterek
Az éterek olyan oxigéntartalmú szerves vegyületek, amelyek molekuláiban az oxigénatomhoz két szénatom kapcsolódik. A kisebb szénatomszámú éterek folyadékok, míg a nagyobbak kristályosak.
Elnevezés: az oxigénatomhoz kapcsolódó szénhidrogéncsoportok neve abc-sorrendben, mögé illesztve az éter szócskát. Pl.:
CH3-O-CH3 dimetil-éter Szerkezet:* a szén- és az oxigénatom közötti kötés poláris, emiatt az egész molekula kis mértékben poláris (dipólusos).
2.2.1. Dietil-éter
Színtelen, jellemző édeskés szagú (bódító), gyúlékony folyadék, amelynek forráspontja 35 Celsius. Vízben kismértékben, alkoholban korlátlanul oldódik. Gőzei levegővel robbanóelegyet képeznek. Toxikus hatása miatt altatásra ma már nem használják, elsősorban oldószerként alkalmazzák. Égésének reakcióegyenlete:
C2H5-O-C2H5 + 6O2 = 4CO2 + 5H2O
A dietil-éter gőzei levegővel robbanóelegyet képeznek.
3. Oxovegyületek
Az oxovegyületek olyan szerves vegyületek, melyekben ún. oxocsoport található. Abban az esetben, ha az oxocsoport láncvégi szénatomhoz kapcsolódik aldehidről, ha láncközti vagy gyűrűs szénatomhoz ketonról beszélünk.
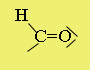
3.1. Aldehidek
Elnevezés: alapszénhidrogén nevéhez -al szócska. Pl.: metanal (CH2O). Az alkánokból levezethető aldehidek típusneve: alkanal. Az aldehidek lehetséges funkciós csoportjait az alábbi ábrák szemléltetik.
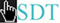
Szerkezet:* a szén-oxigén (karbonilcsoport) közötti kötés erősen poláris, mert a nagy elektronegativitású oxigénatom a pi-kötés elektronpárját maga felé vonzza.
3.1.1. Formaldehid (metanal)
A legegyszerűbb aldehid. Színtelen, szúrós szagú, mérgező gáz. Vízben jól oldódik, vizes oldata a formalin. Tartósítás és fertőtlenítés mellett a műanyaggyártás fontos alapanyaga. A konyhában megtalálható laminált bútorlapok formaldehiddel bevontak, amely lassan ugyan, de párolog, így egészségkárosító hatású. Napjainkban az EU-szabványok már szigorú feltételeket szabnak ezen termékekre is.
A formaldehid mérgező, a fehérjéket kicsapja, sejtméreg!
3.1.2. Acetaldehid (etanal)
Színtelen, kellemetlen szagú, alacsony forráspontú (20C) folyadék. Többi tulajdonságaiban nagyon hasonlít a formaldehidhez. Többek közt az etil-alkohol oxidációjakor keletkezik. Az acetaldehid komoly egészségkárosító hatással bír, ismereteink szerint nagyban hozzájárul a száj- és nyelőcsődaganatok kialakulásához. A dohányfüst és az alkohol nagymértékben emeli az acetaldehid szintet a szájban és a gyomorban. Olvasd el fent, a sörös poharak melletti részt is!
3.2. Ketonok
Olyan oxovegyületek, amelyek molekuláiban az oxocsoport láncközi vagy gyűrűs szénatomhoz kapcsolódik.
Elnevezés: alapszénhidrogén nevéhez -on szócska. Pl.: propanon (CH3-CO-CH3). Az oxocsoport helyzetét a végződés elé tett számmal adjuk meg (propán-2-on).
Szerkezet:* A karbonilcsoport erősen poláris, mivel az oxigénatom nagy elektronegativitású a pi-kötés gyengén kötött elektronpárját nagy mértékben magához vonzza. Emiatt a ketonok között erős másodrendű kötések, ún. dipólus-dipólus kölcsönhatás lép fel.
3.2.1. Aceton (propán-2-on)
A legegyszerűbb és legismertebb keton. Színtelen, kellemes szagú, tűzveszélyes folyadék. Vízzel és szerves oldószerekkel is elegyedik. Elsősorban oldószerként használják.
4. Karbonsavak
A karbonsavak jellemző funkciós csoportja a karboxilcsoport, amely két egyszerű funkciós csoportból, egy hidroxi- és egy oxocsoportból épül fel. Az azonos szénatomhoz kapcsolódó funkciós csoportok nem függetlenek egymástól, emiatt új, az önálló funkcióscsoportokra eredetileg nem jellemző tulajdonságok jelennek meg. Az ilyen molekularészeket összetett funkciós csoportnak nevezzük.
A karbonsavakkal később ismerkedünk, elöljáróban csak annyit, hogy ide tartozik az ételízesítő ecet is.
Mi látható a képen? Az oxigéntartalmú szénvegyületek melyik ALcsoportjába tartozik?
Mi látható a képen? Az oxigéntartalmú szénvegyületek melyik ALcsoportjába tartozik?
Az oxigéntartalmú szénvegyületek fizikai és kémiai tulajdonságai*