6. Kőzetek a "mikroszkóp" alatt
Az feltehetően mindenki számára egyértelmű, hogy a kőzetek szilárd halmazállapotú anyagok. Az azonban már keveseknek, hogy a szilárd anyagoknak két formája lehet. A kémiailag szilárd anyagok ún. kristályráccsal rendelkeznek (a szilárd anyagok többsége), a fizikailag szilárd anyagok kristályráccsal nem rendelkeznek, ún. amorf anyagok (üveg).
Ha egy nagyon nagy nagyítású mikroszkóppal megnéznénk a kőzeteket láthatóvá válna, hogy természetesen ők is kémiai alkotókból, atomokból, (molekulákból) vagy ionokból épülnek fel. Ezek a kémiai részecskék az ún. rácspontokban helyezkednek el, ott helyhez kötöttek, de helyükön rezgőmozgást végeznek. A rácspontokban lévő részecskéket különböző kölcsönhatások "rögzítik" helyükön. A részecskék által kialakított legkisebb egységet, amelyből a kristályrács felépül elemi cellának nevezzük.
A kristályrács rácspontjaiban különböző részecskék lehetnek: atom, molekula, ion, fématomtörzs. Ennek megfelelően megkülönböztetünk atom-, molekula-, ion- és fémrácsot. Mielőtt azonban belevágánák némi ismétlésre és nem kevés új ismeret elsajátítására van szükséged.
Elektronszerkezet
A Mit csinál egy tudós?
epochában már megismerkedtél az elemi részecskékkel, tudod, hogy az atomokat protonok, neutronok és elektronok építik fel, sőt azt is, hogy az elektronok az elektronfelhőben keringenek. Tisztában vagy azzal, hogy az atomokban a protonok és elektronok száma megegyezik és azzal is, hogy az elektronok elektronhéjakra rendeződnek. A kérdés most az, hogyan? Az atommag körül - az elektronok számának függvényében - egy vagy több ún. főhéj helyezkedik el. Ezeken a héjakon pontosan meg van adva, hogy hány elektron keringhet. Az 1-es főhéjon 2, a 2-esen 10, a 3-ason 28 és folytathatnánk. A főhéjak mellékhéjakra tagolódnak. Az 1-es főhéjnak csak egyetlen mellékhéja van, ez az "s" mellékhéj, míg a 2-es főhéjnak két mellékhéja "s" és "p", a 3-asnak pedig három "s", "p", "d". Az "s" mellékhéjon mindig 2, a "p"-n mindig 6, a "d"-n mindig 10 elektron keringhet. Nézzük ezt most meg egy összefoglaló táblázatban!
6.1. Hány elektron lehet maximálisan az egyes (1., 2., 3.) főhéjakon?
Nézzük akkor most mindezt a gyakorlatban!
A hidrogénnek egyetlen elektronja van. Elektronhéjait így jelöljük: 1s1 azaz az egyes főhéj, "s" mellékhéján egyetlen elektron van. A lítium három elektronjához már nem elegendő az 1. főhéj, így kiépül a 2. is. Jelölése: 1s22s1. Azaz a fentiekben leírtaknak megfelelően az első főhéjon kettő, a második főhéjon egy elektron kering. Az érthetőség kedvéért megadjuk még néhány atom elektronszerkezetét.
7N 1s22s22p5
13Al 1s22s22p63s23p1
20Ca 1s22s22p63s23p63d2
6.2. Most rajtad a sor! Add meg a következő atomok elektronszerkezetét: C, P, Cl.
6.3. Emlékezz csak vissza a periódusos rendszerről tanultakra! Mit mutat meg a periódus szám? Mit mutat meg a főcsoportszám?Ionok
A 8. főcsoport elemeit nemesgázoknak nevezzük, hisz ők a legstabilabbak. Ez azzal magyarázható, hogy legkülső héjaik telítettek. Minden atom arra törekszik, hogy legkülső elektronhéja telített legyen, másképp fogalmazva, hogy elérje a nemesgáz-szerkezetet. Ezt vagy úgy teheti meg, ha felvesz elektron(oka)t vagy, ha lead.
Vizsgáljuk meg az első főcsoport elemeit (Li, Na, K stb.). Legkülső elektronhéjukon 1 elektron van, konkrétan a Li elektronszerkezete 1s22s1. Azonban, ha lead egy elektront akkor eggyel több protonja lesz, így már nem tekinthető semlegesnek. Az eggyel több proton pontosan eggyel több pozitív töltést jelent majd, így jön létre a lítiumion Li+. Az első főcsoport valamennyi eleme úgy lesz stabil, hogy leadnak egy elektront, így egyszeresen pozitív ionná alakul. A gondolat a második és a harmadik főcsoportra is alkalmazható, ezek az elemek azonban kettő, illetve három elektront adnak le, azaz kétszeresen, illetve háromszorosan pozitív ionokká alakulnak. Pl. Mg2+, Al3+.
Mi a helyzet a magasabb főcsoportszámú elemekkel. A 8. főcsoport elemei ugyebár stabilak így nem adnak és nem is vesznek fel elektront. A hetedik főcsoport eleminek legkülső főhéján 7 elektron van.
Pl. F 1s22s22p5 Cl 1s22s22p63s23p5
Nem lenne logikus, hogy 7 elektront adjanak le, az azonban már igen, hogy hét legkülső elektronjukat eggyel kiegészítve stabilizálódjanak. Ha azonban felvesznek egy elektront eggyel több negatív töltésük lesz, mint pozitív, így egyszeresen negatív ionná válnak. A negatív ionok -id végződést kapnak, ennek megfelelően fluoridion F-, kloridion Cl- stb.
Igazán nem nehéz a hatodik és ötödik főcsoport elemeinek ionná alakulását kitalálni. A hatodik főcsoport elemei kettő, az ötödiké három elektront vesznek fel, így kétszeresen, illetve háromszorosan negatív ionná válnak. Az ionok tehát nem mások, mint töltéssel rendelkező részecskék.
6.4. Írd fel az alábbi ionok jelölését: nátriumion, kalciumion, bórion, oxidion, bromidion.
6.5. Melyik atom ionját nevezzük szulfid-ionnak?
Kristályrácsok és kémiai kötések
A kémiailag szilárd anyagok négyféle krostályrácsba rendeződhetnek
Atomrács
Az atomrács esetében a rácspontban lévő atomokat ún. kovalens kötés tartja össze. A kovalens kötés egy kémiai kötés, amely két atom elektronfelhőjének átfedésével jön létre.
A kovalens kötést két példával illusztrálnánk. Első példánkban vegyünk két hidrogén atomot. A hidrogén atomoknak egy-egy legkülső elektronja van. Ha a két hidrogén atom megfelelő közelségbe kerül egymáshoz elektronfelhőjük először deformálódik, majd az egy-egy elektron egyetlen közös elektronpályára kerül, kialakítva a hidrogén molekulát.
Második példánkban két különböző atomot veszünk. Az egyik a hidrogén a másik a klór. A hidrogénnek egy, a klórnak hét legkülső elektronja van. A klór elektronjai arra törekednek (és minden más atomé is), hogy párosával legyenek (az emberek sem szeretnek egyedül lenni normális esetben). Hat elektron párban lesz (3 pár), egynek azonban nem lesz párja. Ha a hidrogén és a klór megfelelő közelségben kerül a hidrogén egyetlen és a klór egy párosítatlan elektronja kialakítja a kovalens kötést.
A kovalens kötésnek létezik kétszeres és háromszoros változata is.
6.6. A szerkezeti képletek segítségével magyarázd el a kétszeres és a háromszoros kovalens kötés kialakulásának mechanizmusát!
Tipikus atomrácsos elem a szén két módosulata a gyémánt és a grafit.
Az atomrácsos anyagokra magas olvadás- és forráspont jellemző.
Molekularács
A molekularácsos anyagokat a kén molekula példáján szemléltetjük. A kénatomok 8 atomos molekulát képeznek, ezek (a nyolc atomból álló) molakulák lesznek a rácspontokban. A kénatomok között kovalens kötés van, a kénmolekulák között azonban csak gyengébb kötések. Melegítés hatására ezek a gyengébb kötések hamar felszakadnak és a molekula megolvad. Ezzel magyarázható a molekularácsos anyagoknak alacsony forrás- és olvadáspontja.
A kémiai kötések két nagy csoportba oszthatók. Vannak az elsőrendű és a másodrendű kötések. Ezekről jelenleg elég csak annyit kell tudnod, hogy az elsőrendű kémiai kötések sokkal nehezebben szakíthatók fel, mint a másodrendűek. Elsőrendű kötések közé tartozik a kovalens, az ionos és a fémes kötés, ezekről ebben a fejezetben tanulsz. A másodrendű kötések közül a hidrogénkötésről a víz epochában tanulsz majd.
IonrácsIonrács esetén a rácspontokban egyszerű, vagy összetett pozitív, illetve negatív ionok helyezkednek el. A fejezet elején egyszerű ionokról tanultál. Az összetett ionok atomcsoportok elektron vesztésével, illetve bővülésével jönnek létre. Pl. NO3- - nitrátion, CO32+ - karbonátion.
Az ionokat ionos kötés tartja össze, amely az ellentétes töltésű ionok vonzásának köszönhető. Egyszerű ionokból épül fel a nátrium-klorid (Na+, Cl- konyhasó) ionrácsa, a mészkő (kalcium-karbonát Ca2+, CO32+) ionrácsában azonban már összetett ion is van. Az ionok az atomokhoz hasonlóan jelentős vonzást gyakorolnak elektronjaikra, így ezek helyhez kötöttek. A következmény, hogy nem vezetik az elektromos áramot. Mivel az ionok töltéssel rendelkező részecskék, olvadék formájában már vezetők lesznek. Az ionrácsos vegyületek kiválóan oldódnak vízben.
FémrácsA fémrács rácspontjaiban olyan fématomok vannak, amelyek legkülső elektronjaikat leadták, így ún. pozitív fématomtörzzsé alakultak. A leadott elektronok nem helyhez kötöttek (delokalizáltak) ezért az áramot vezetik. A delokalizált elektronok fogják a rácsot összetartó fémes kötést kialakítani.
Elektronegativitás
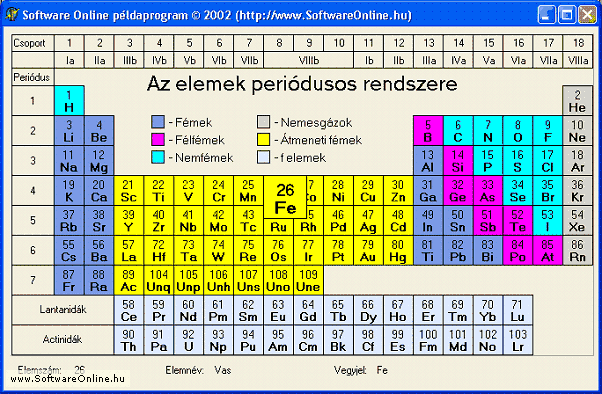
Honnan lehet megállapítani, hogy két elem között milyen kémiai kötés alakul ki? Ebben az elektronegativitás segít. Az elektronegativitás a kötésben lévő atom elektronvonzó képességét fejezi ki, értéke a periódusos rendszerből olvasható le, jele: EN.
6.7. Mekkora az alábbi atomok elektronegativitása: H, C, O?
A kémiai kötés jellegének megállapításához először abból indulunk ki, hogy azonos vagy különböző atomok közt jön létre. Ha két azonos atomról van szó és elektronegativitásuk kisebb, mint 1,9 akkor fémes, ha nagyobb annál akkor kovalens kötést alakítanak ki. Ha különböző atomokról van szó akkor az elektronegativitás-különbségüket kell nézni. Ha az kisebb 1,5-nél akkor kovalens, ha nagyobb akkor ionos kötést alakítanak ki. Nézzünk néhány példát!
Milyen kötés alakul ki két oxigénatom közt? ENO=3,5, ez nagyobb, mint 1,9, így kovalens.
Milyen kötés alakul ki két kalciumatom közt? ENCa=1, ez kisebb, mint 1,9, így fémes.
Milyen kötés alakul ki a nátrium és a klór között? ENNa=0,9; ENCl=3, ENkülönbség=2,1 ez nagyobb, mint 1,5, így ionos.
Milyen kötés alakul ki a hidrogén és az oxigén között? ENH=2,1; ENOl=3,5, ENkülönbség=1,4 ez kisebb, mint 1,5, így kovalens.
6.8. Milyen kötés alakul ki az alábbi atomok között? S-S, S-O, Mg-O, Zn-Zn
kémiailag szilárd, fizikailag szilárd, rácspont, elemi cella, főhéj, mellékhéj, kovalens kötés, atomrács, ionrács, elsőrendű kötés, másodrendű kötés, molekularács, fémrács, ionos kötés, egyszerű ion, összetett ion, fémes kötés, elektronegativitás