A víz kémiai szerkezete miatt számtalan különleges tulajdonsággal
bír. Amellett, hogy Földünk leggyakoribb vegyülete, az élet számára nélkülözhetetlen.
Az egyetlen vegyület, amely mindhárom halmazállapotban előfordul, s mint megtudtuk
a leggyakoribb oldószer. Vizsgáljuk meg ezeket a különleges tulajdonságokat!
A víz halmazállapot-változásai
 2.1.
Ismételjük át mit tanultál a víz tulajdonságairól a Mit csinál egy tudós epochában!
2.1.
Ismételjük át mit tanultál a víz tulajdonságairól a Mit csinál egy tudós epochában!
Definiáld a forrás, forráspont, olvadás, olvadáspont fogalmát!
Mi a különbség a párolgás és a forrás között?
Hogyan állapítanád meg a víz forrás- és olvadáspontját?
Mennyi a víz forrás- és olvadáspontja?
Hogyan változik a víz hőmérséklete a forralás során?
Hogyan változik a víz forráspontja a tengerszint feletti magasággal?
 Ezekről
itt tanultál.
Ezekről
itt tanultál.
 I.
Tegyetek műanyag pohárba vizet, jelöljétek be a vízszintet, majd fagyasszátok
le!
I.
Tegyetek műanyag pohárba vizet, jelöljétek be a vízszintet, majd fagyasszátok
le!
Hogyan változott a víz térfogata?
II. Dobjatok jégdarabokat egy pohár vízbe!
Mi mondható el a folyékony és a szilárd halmazállípotú víz sűrűségéről?
III. A víz forráspontjának meghatározása
Szükséges eszközök: Bunsen-állvány, dió, hőmérő, vasháromláb,
azbesztháló, főzőpohár.
A főzőpoharat töltsetek meg 2/3-ig vízzel, majd helyezzétek
az azbeszthálóra. Az állvány segítségével a hőmérőt helyezzétek a vízbe, majd
kezdjétek el melegíteni.
 2.2.
Amikor jól láthatóan forrni kezd a víz olvassátok le a hőmérsékleti értéket!
2.2.
Amikor jól láthatóan forrni kezd a víz olvassátok le a hőmérsékleti értéket!
2.3. Hogyan változik a víz forráspontja további melegítés hatására?
2.4. Mindig ezen a hőmérsékleti értéken forr a víz? Milyen körülményektől
függ a víz forráspontja?
2.5. Rajzoljátok le a kísérletet, illetve azt, hogyan változott a víz hőmérséklete?
Amikor a víz megfagy, a hidrogénkötések főszereplésével
egy tetraéderes szerkezet alakul ki, amelyben a térkihasználás elég rossz,
így nagy hézagok, üregek vannak. Ez okozza azt, hogy a jég sűrűsége kisebb,
mint a vízé és fagyáskor a többi anyagtól eltérően a víz térfogata megnő (mintegy
9%-kal). A jég 9 féle módosulatban kristályosodik ki.
A forrás-, olvadáspontot, a sűrűséget, továbbá a színt, szagot
és halmazállapotot egy anyag fizikai tulajdonságainak nevezzük
A felületi feszültség
 IV.
Töltsetek meg egy főzőpoharat 2/3-ig vízzel, majd óvatosan helyezzetek rá
egy pengét!
IV.
Töltsetek meg egy főzőpoharat 2/3-ig vízzel, majd óvatosan helyezzetek rá
egy pengét!
Mit tapasztaltok?
|
|
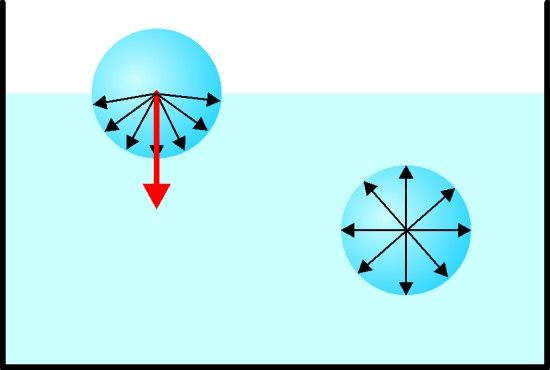
A folyadékok felülete bizonyos szempontból rugalmas hártyához hasonlóan
viselkedik, a vízfelszínre helyezett penge alatt a víz hártyaszerűen
behajlik. A jelenséget felületi feszültségnek nevezzük.
A magyarázat megértéséhez a következőképpen gondolkozzunk: a folyadék
belsejében lévő részecskék egymással kölcsönhatásban vannak, egy-egy
részecske valamennyi őt körülvevő részecskére vonzást gyakorol. A
felszínen lévő részecskékre azonban a belső részecskék nagyobb vonzást
gyakorolnak, mivel a felfelé irányuló vonzás hiányzik. Így a vonzóerő
a felszínen lévő molekulákat befelé húzza, csökkenteni igyekszik a
felületet.
|
A felületi feszültség a folyadékok alapvető tulajdonsága,
ami miatt a folyadékok a lehető legkisebb fajlagos felületű alakzatot (gömb)
igyekeznek felvenni, ha külső erőtér nem hat rájuk. Oka a folyadék részecskéi
(atomok, egyszerű és összetett ionok, molekulák) között fellépő kohéziós
(összetartó) erő. Ezért gömb alakú a kis méretű lebegő folyadékcsepp, vagy
a szappanbuborék stb.
 Nézd
meg a szabadon eső vízcsepp alakját itt!
Nézd
meg a szabadon eső vízcsepp alakját itt!
 A felületi feszültség következménye, hogy bizonyos tárgyak
és állatkák a vízben nem süllyednek el, a víz felületén maradnak, bár a sűrűségük
nagyobb, mint a folyadéké. Ilyen például a molnárpoloska, ismertebb nevén
molnárka.
A felületi feszültség következménye, hogy bizonyos tárgyak
és állatkák a vízben nem süllyednek el, a víz felületén maradnak, bár a sűrűségük
nagyobb, mint a folyadéké. Ilyen például a molnárpoloska, ismertebb nevén
molnárka.
A felületi feszültségre vonatkozó törvényszerűségek vizsgálatában
kiemelkedő munkát végzett az egyik legnagyobb magyar fizikus, Eötvös Loránd.
 V.
Nézzetek utána ki volt Eötvös Loránd.
V.
Nézzetek utána ki volt Eötvös Loránd.  Egy kis segítség.
Egy kis segítség.
VI. Ismételjétek meg a IV. kísérletet úgy, hogy a vízbe tegyetek
kevés mosószert!
Mit tapasztaltok?
A vízbe adagolt mosószerek módosítják a víz felületi feszültségét,
ezért felületaktív anyagoknak (detergensnek vagy tenzideknek)
nevezzük.
A felületi feszültségnek, illetve a kohéziós erőnek számtalan
jelentősége van a minden napi életben. Ha érdekel, hogyan jut a növények gyökeréből
a levelébe a víz (kapilláris emelkedés) vagy miért mos a mosógép érdemes meglátogatnod
 ezt
a linket!
ezt
a linket!
 VII.
Végezzétek el a IV. kísérletet acetonnal és etil-alkohollal!
VII.
Végezzétek el a IV. kísérletet acetonnal és etil-alkohollal!
Milyen a felületi feszültségük a vízhez viszonyítva?
A felületi feszültség függ a folyadék anyagi minőségétől és a felülettel
érintkező anyagtól. A víz felületi feszültsége általánosságban nagynak mondható.
Fajlagos hőkapacitás
A víz nagyon gyakran
használt fűtő- (pl.: távfűtés) és hűtőközeg (pl.: Paksi Atomerőmű), mert igen
nagy a fajlagos hőkapacitása (régi nevén fajhője). Fajlagos hőkapacitásnak
azt az energiát nevezzük, amely 1 kg tömegű anyag hőmérsékletét 1 fokkal (K)
emeli. Másképp mefogalmazva megmutatja, hogy mennyi hőt kell közöljek a rendszerrel
annak érdekében, hogy egy kilógrammnyi részének hőmérséklete egy fokkal emelkedjen.
A fajlagos hőkapacitás jele: C, mértékegysége:
J/K (ejtsd: zsúl per kelvin).
 VIII.
Nézzetek utána ki volt James Prescott Joule és Thomson William Kelvin vagy
másnéven Lord Kelvin!
VIII.
Nézzetek utána ki volt James Prescott Joule és Thomson William Kelvin vagy
másnéven Lord Kelvin!
A fajlagos hőkapacitás az alábbi képlettel fogalmazható
meg matematikailag:
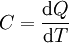 ahol C a fajlagos hőkapacitás, dQ a felvett/leadott hőmennyiség, dT a hőmérséklet
változása.
ahol C a fajlagos hőkapacitás, dQ a felvett/leadott hőmennyiség, dT a hőmérséklet
változása.
A víz fajlagos hőkapacitása a
többi anyaghoz viszonyítva nagynak tekinthető, pontos értéke 20 °C-on c
= 4187 J × kg-1 x K-1. Ennek köszönhető, hogy jelentős
szerepet játszik az éghajlat és az időjárás alakulásában, de ezzel magyarázható
az is (többek közt), hogy a tavak alsó vízrétegei télen nem fagynak be, így
az élőlények életben maradnak. Az élő szervezetben lejátszódó exoterm kémiai
reakcióknál a nagy fajhő akadályozza meg a hőmérsékletemelkedést.
 2.6.
A fajlagos hőkapacitás ismeretében magyarázd meg miért érezzük este melegebbnek
a Balaton vizét!
2.6.
A fajlagos hőkapacitás ismeretében magyarázd meg miért érezzük este melegebbnek
a Balaton vizét!
Mivel a víz fajhője kétszer, háromszor nagyobb, mint a szárazföldet
felépítő anyagoké ezért kétszer, háromszor annyi hőenergia növeli 1 °C-kal
hőmérsékletét, mint amennyi azonos tömegű szárazföldi anyag hőmérsékletének
1 °C-os emeléséhez szükséges. Ezért a tengervíz lassabban és kevésbé melegszik
fel, lassabban és kevésbé hűl le, mint a szárazföld; így végeredményben hőfelhalmozóként
viselkedik. A nyáron elraktározott roppant hőmennyiséget télen lassan bocsátja
ki. Ennek egyik legfontosabb következménye, hogy a szomszédos szárazföldi
területek éghajlatára kiegyenlítő hatással van (télen fűt, nyáron hűt). Nyugat-
és Észak-Európa, de még a Kárpát-medence éghajlatára is jelentős befolyással
bír az Atlanti-óceán hőháztartása.
Hozzájárul ehhez, hogy a tengervíz sokkal
nagyobb mélységig melegszik fel, mint a szárazföld, mert a napsugarak 200
m mélyen hatolhatnak a vízbe. (A hősugarak általában 30 m mélységig melegítenek,
azon túl már csak a fény hatol be.) A víz hullámzása és áramlása még tovább
növeli a felmelegedő vízréteg vastagságát. Az Északi-tengerben például a nyár
folyamán 30-40 méter vastag vízréteg melegszik át. Eddig a mélységig – a hullámzás
átkeverő hatása miatt – nagyjából azonos a víz hőmérséklete, lejjebb azonban
még a legmelegebb nyárban is ugrásszerűen csökken a hőmérséklet (hőmérsékleti
ugróréteg).
Az óceánok mélyvizei – még az Egyenlítő alatt
is – roppant hidegek (átlagosan +2 oC-osak). Ez a hideg víz ún.
mélyáramlásokkal, magasabb földrajzi szélességek felől érkezik, mégpedig állandóan,
hiszen ellenkező esetben a melegebb égövekben már át kellet volna melegednie.
Bizonyítható, hogy az ún. trópusi felszálló hideg vizek főleg az Antarktisz
vidékéről származnak. Nagyon fontos a tengerbiológiai szerepük, mert oxigénben
gazdagok, így az élőlények számára kedvezőek (nagy plankton- és halállományok
kialakulása).
*Párolgáshő
Hasonlóan a fajhőhöz a víz párolgáshője is
igen nagy. A párolgáshő egységnyi mennyiségű anyag állandó hőmérsékleten történő
elpárologtatásához szükséges energia. Mértékegysége a J/mol vagy a J/kg. Előző
a moláris párolgáshő, az utóbbi a fajlagos párolgáshő mértékegysége. A moláris
párolgás hő értelmezéséhez szükséges a mol fogalmának megismerése.
A párolgáshő tulajdonképpen úgy tekinthető,
mint az az energiamennyiség, ami ahhoz szükséges, hogy az adott (szilárd vagy
folyékony) anyag molekuláit összetartó kötési erőket felszabadítsa. Ez az
energiamennyiség az adott anyag molekuláinak rezgő (hő)mozgását növeli meg
annyira, melyet a szomszédos molekulák illetve atomok már nem tudnak kompenzálni,
így az adott molekula kiszabadul, és légnemű halmazállapotúvá, (gőzzé) válik.
A párolgáshő mértéke az anyagminőségtől, a környezeti nyomástól és a hőmérséklettől
is függ.
Víz esetén 2,25×106 J/kg. Szervezetünk
hőháztartásában a víz nagy párolgáshője miatt kap szerepet, hiszen 1 g víz
elpárologtatása bőrünkön keresztül 2 kJ energiát von el. Ezért fázunk, amikor
kilépünk a fűrdőkádból.
 fizikai
tulajdonság, felületi feszültség, felületaktív anyagok, fajlagos hőkapacitás,
fajhő, *párolgáshő
fizikai
tulajdonság, felületi feszültség, felületaktív anyagok, fajlagos hőkapacitás,
fajhő, *párolgáshő
 2.1.
Ismételjük át mit tanultál a víz tulajdonságairól a Mit csinál egy tudós epochában!
2.1.
Ismételjük át mit tanultál a víz tulajdonságairól a Mit csinál egy tudós epochában! Ezekről
itt tanultál.
Ezekről
itt tanultál. I.
Tegyetek műanyag pohárba vizet, jelöljétek be a vízszintet, majd fagyasszátok
le!
I.
Tegyetek műanyag pohárba vizet, jelöljétek be a vízszintet, majd fagyasszátok
le! 2.2.
Amikor jól láthatóan forrni kezd a víz olvassátok le a hőmérsékleti értéket!
2.2.
Amikor jól láthatóan forrni kezd a víz olvassátok le a hőmérsékleti értéket!
 A felületi feszültség következménye, hogy bizonyos tárgyak
és állatkák a vízben nem süllyednek el, a víz felületén maradnak, bár a sűrűségük
nagyobb, mint a folyadéké. Ilyen például a molnárpoloska, ismertebb nevén
molnárka.
A felületi feszültség következménye, hogy bizonyos tárgyak
és állatkák a vízben nem süllyednek el, a víz felületén maradnak, bár a sűrűségük
nagyobb, mint a folyadéké. Ilyen például a molnárpoloska, ismertebb nevén
molnárka.