 A természettudósok
a vizet sokáig az egyszerű anyagok közé sorolták. Szerkezeti felépítését csak
a XVIII. sz második felében sikerült tisztázni. Henry Cavendish angol kémikus
megfigyelte, hogy hidrogén (ezt akkoriban gyúlékony levegőnek hívták) és levegő
(akkoriban közönséges levegő) robbantásakor a hidrogén és a levegő 1/5-e egyesül
(a levegő 21%-a oxigén) és páraként csapódik le. Tehát a pára hidrogénből
és oxigénből áll. Cavendish a későbbiekben a térfogati viszonyokat is vizsgálta,
s azt kapta, hogy két egység hidrogénből és egy egység oxigénből keletkezik
a víz. Kísérleteit a francia származású Antoine Lavoisier (Lavoisier
korábbi tanulmányodban) összegezte, illetve következtetett a végső megoldásra.
Lavoisier 1783-ban bejelentette, hogy a víz két egység hidrogénből és egy
egység oxigénből áll. Azaz összegképlete: H2O.
A természettudósok
a vizet sokáig az egyszerű anyagok közé sorolták. Szerkezeti felépítését csak
a XVIII. sz második felében sikerült tisztázni. Henry Cavendish angol kémikus
megfigyelte, hogy hidrogén (ezt akkoriban gyúlékony levegőnek hívták) és levegő
(akkoriban közönséges levegő) robbantásakor a hidrogén és a levegő 1/5-e egyesül
(a levegő 21%-a oxigén) és páraként csapódik le. Tehát a pára hidrogénből
és oxigénből áll. Cavendish a későbbiekben a térfogati viszonyokat is vizsgálta,
s azt kapta, hogy két egység hidrogénből és egy egység oxigénből keletkezik
a víz. Kísérleteit a francia származású Antoine Lavoisier (Lavoisier
korábbi tanulmányodban) összegezte, illetve következtetett a végső megoldásra.
Lavoisier 1783-ban bejelentette, hogy a víz két egység hidrogénből és egy
egység oxigénből áll. Azaz összegképlete: H2O.
 1.1.
Mielőtt tovább lépnénk ismételd át a kémiai kötések kialakulását az alábbi
kérdések segítségével!
1.1.
Mielőtt tovább lépnénk ismételd át a kémiai kötések kialakulását az alábbi
kérdések segítségével!
Hány legkülső elektronja van
a hidrogénnek?
Hány legkülső elektronja van az oxigénnek?
Elektronegativitásuk alapján milyen kémiai kötés alakul ki köztük?
Rajzold le a hidrogénatomot, jelölve a legkülső elektront! |
Rajzold le az oxigénatomot, jelölve a legkülső elektronokat! |
Rajzold le a vízmolekula szerkezeti képletét, jelölve a nemkötő elkektronpárokat! |
|
|
|
|
hidrogénmolekula |
oxigénmolekula |
 vízmolekula |
 A
Mit csinál egy tudós? epochában tanultál a vegyületekről
és a periódusos
rendszer elemiről.
A
Mit csinál egy tudós? epochában tanultál a vegyületekről
és a periódusos
rendszer elemiről.
A kémiai kötésekről a Földünk epochában tanultál itt.
A vízmolekulában a hidrogéneket és az oxigént kovalens kötés kapcsolja össze.
A kovalens kötésnek azon fajtája, amelyet poláris kovalens kötésnek
nevezünk. De mit is jelent ez?
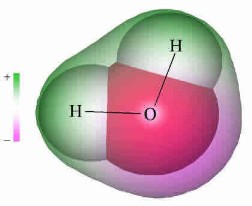
Az oxigén és a hidrogén eltérő elektronnegatívitású, ENO=3,5 , ENH=2,1 , így az oxigén a kötőelektronpárokat jobban maga felé vonzza. Az így kialakuló töltésszétválás okozza a kötés és egyben a molekula polaritását.
 A poláris kötésekben levő H atomok (amelyek
részlegesen pozitív töltésűek) és egy szomszédos vízmolekula (negatív töltésű)
nemkötő elektronpárja között vonzóerő alakul ki. Ez a molekulák közötti kölcsönhatás
egy másodrendű kötés kialakulásához vezet, amit hidrogénkötésnek
nevezünk. A hidrogénkötés kialakulásának feltétele, hogy a hidrogénhez nagy
elektronegativitású atom (pl. N, O, F) kapcsolódjék. A vízmolekulák között
kialakuló hidrogénhíd a legerősebb az intermolekuláris (molekulák közötti)
kölcsönhatások közül. A képen a vízmolekulán belüli töltéseloszlás látható.
Lila színnel a negatívabb, zöld színnel a kevésbé negatívabb területek.
A poláris kötésekben levő H atomok (amelyek
részlegesen pozitív töltésűek) és egy szomszédos vízmolekula (negatív töltésű)
nemkötő elektronpárja között vonzóerő alakul ki. Ez a molekulák közötti kölcsönhatás
egy másodrendű kötés kialakulásához vezet, amit hidrogénkötésnek
nevezünk. A hidrogénkötés kialakulásának feltétele, hogy a hidrogénhez nagy
elektronegativitású atom (pl. N, O, F) kapcsolódjék. A vízmolekulák között
kialakuló hidrogénhíd a legerősebb az intermolekuláris (molekulák közötti)
kölcsönhatások közül. A képen a vízmolekulán belüli töltéseloszlás látható.
Lila színnel a negatívabb, zöld színnel a kevésbé negatívabb területek.
Előző tanulmányaidban már megismerkedtél
a víz kiváló oldószer tulajdonágáról és az oldatokról is tanultál már ![]() itt. Poláris tulajdonsága
miatt a víz a leggyakrabban használt oldószer.
itt. Poláris tulajdonsága
miatt a víz a leggyakrabban használt oldószer.
 Hidrogénkötés kialakulása - animáció
Hidrogénkötés kialakulása - animáció
![]() poláris
kovalens kötés, másodrendű kötés, hidrogénkötés
poláris
kovalens kötés, másodrendű kötés, hidrogénkötés